显微镜分辨率:概念、因素和计算
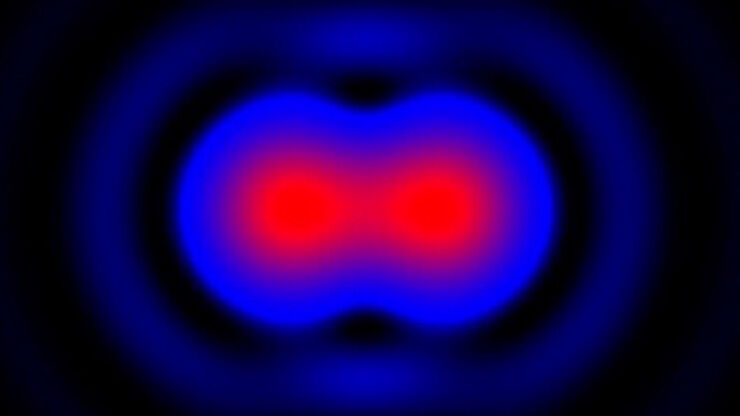
在显微镜学中,‘分辨率’一词用于阐述显微镜对细节进行区分的能力。换言之,这是样本内两个能被观察人员或者显微镜摄像头区分的实体点之间的最小距离。显微镜的分辨率本质上与光学元件的数值孔径(NA)以及用于观察样本标本的光波长有关。此外,我们必须考虑Ernst Abbe于1873年首次提出的衍射极限。本文章包含了这些概念的历史介绍并使用相对简单的术语对其进行了解释。
选择清洁度分析解决方案需考虑的因素
正确的清洁度分析解决方案对质量控制至关重要。本文介绍了选择适合自身需求的解决方案时应考虑的一些重要因素。这些因素取决于不同的方面,例如:(微电子或汽车)行业,污染物类型、尺寸、成分、材料属性和可能造成的损害等。从基本的清洁度验证到更复杂的分析,有多种基于显微镜和激光光谱的清洁度解决方案可供选择。
高效颗粒计数和分析
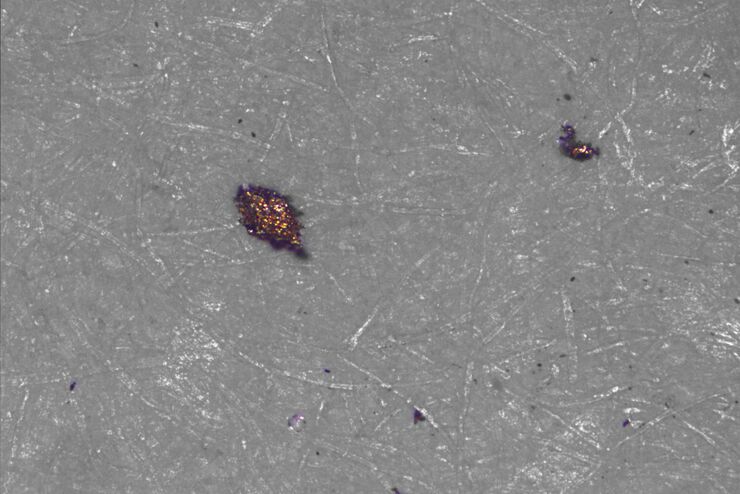
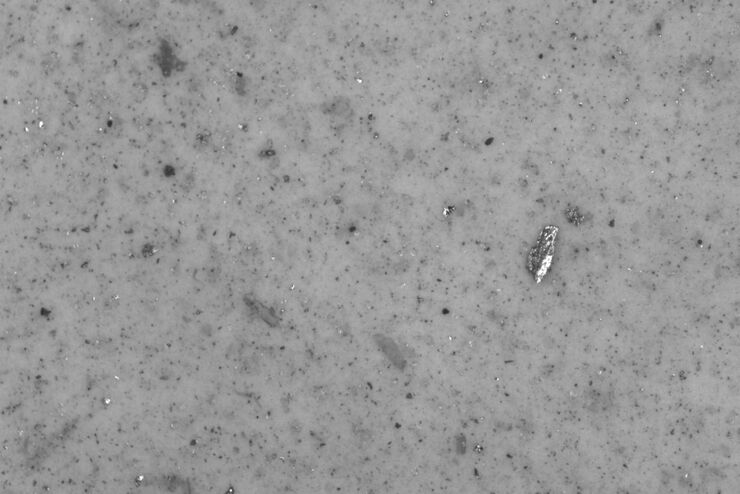
本报告介绍了使用光学显微镜对零部件的清洁度进行颗粒计数和分析的方法。颗粒计数和分析对汽车和电子行业的质量保证非常重要。颗粒污染可能会导致零部件退化或失效。清洁度分析能快速确定颗粒的大小、类型以及造成损坏的概率。对于更高级的分析(如确定颗粒成分),则可以使用光学显微镜和激光诱导击穿光谱(LIBS)。
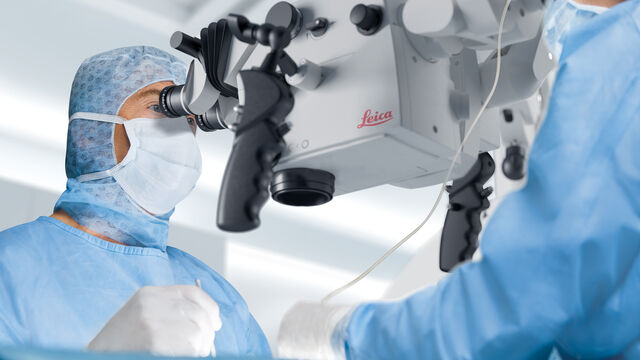
显微镜下的质量控制
电动汽车需求的快速增长是推动市场发展的重要因素,但不是唯一因素,其他因素包括可再生能源装置日益普及(如光伏板),各种医疗设备广泛采用锂离子电池,以及便携式消费电子产品的市场逐步扩大。
汽车零部件的清洁度
本文讨论了ISO 16232标准和VDA 19指南,并简要总结了颗粒物分析方法。它们为汽车零部件在微粒污染方面的清洁度提供了重要标准。此类颗粒物会对产品性能和寿命产生影响。在清洁度分析中,可以使用自动光学显微镜方法来确定颗粒物类型、大小和造成损坏的可能性。有时,需要更多成分信息,才能准确找到潜在的损害和污染源。这时候就需要借助激光光谱(LIBS)或电子显微镜。
如何为免疫荧光显微镜制备样本
免疫荧光(IF)是一种用于可视化观察细胞内过程、状态和结构的强大工具。IF制剂可通过多种显微镜技术(如激光共聚焦、宽场荧光、全内反射成像等)来加以分析,具体取决于应用目的或研究人员的关注重点。与此同时,在很多使用至少一套简易荧光显微镜的研究工作组当中,IF早已成为不可缺少的一部分。
荧光显微镜如何为工业应用带来益处
观看这个免费的网络研讨会,了解更多关于荧光显微镜在工业应用中的用途。我们将涵盖一系列调查研究,在这些研究中,荧光对比度为样本属性提供了新的见解,例如纤维、文件、涂料、建筑材料、电子产品和食品的属性。您将看到使用荧光有多么简单,同时还将了解样本制备和潜在局限性。
如何为目视检查选择正确的解决方案
本文可帮助用户在选择显微镜作为常规目视检查解决方案时做出决策。其中描述了应考虑的重要因素。
美国联邦法规第21章第11款和其他相关法规简介
本文概述了在美国(联邦法规第21章第11款)、欧盟(GMP附录11)和中国(NMPA)所用电子记录(数据输入、存储、签名和审批)的法规和指南,这些法规和指南会对医疗器械质量控制的数字化增强检测解决方案产生影响。与纸质记录方法相比,使用显微镜进行数字化增强检测具有更一致和更高效的检测优势。但是,与纸质记录和签名的规定相比,电子记录和签名的规定有明显不同的建议和要求。电子记录的创建、验证、存储和备份应…