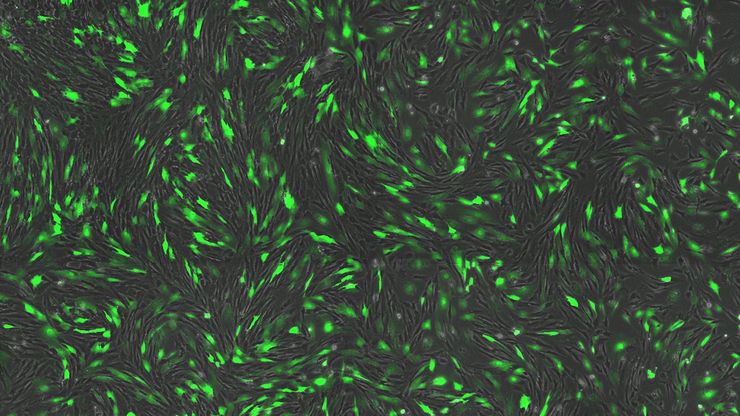
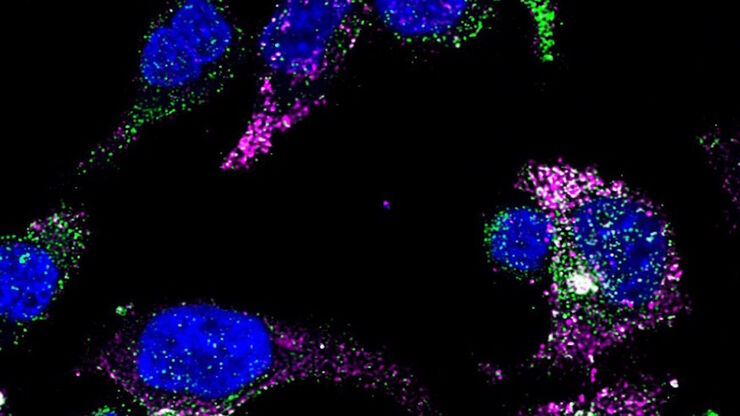
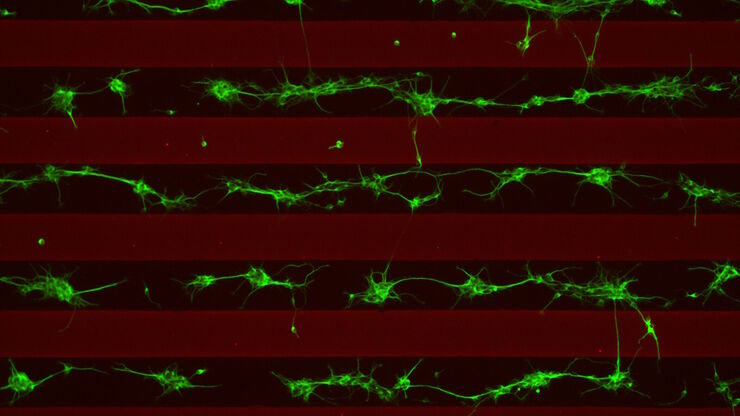
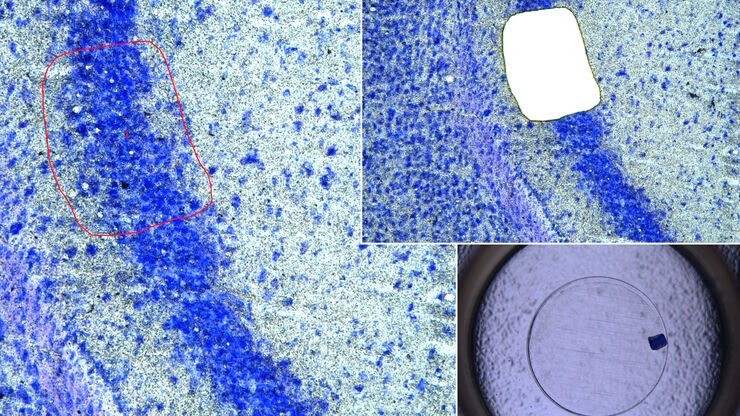
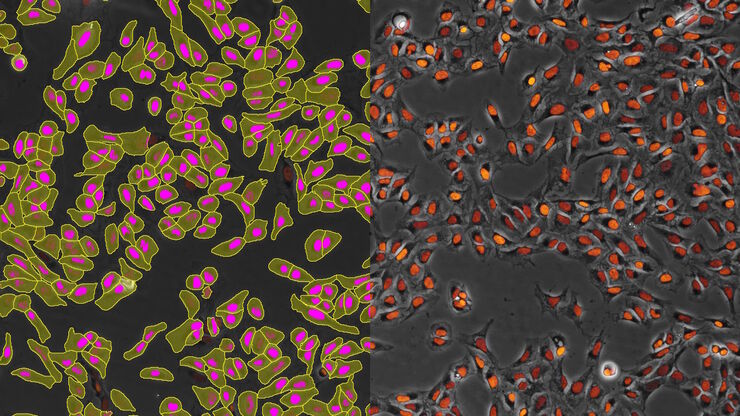
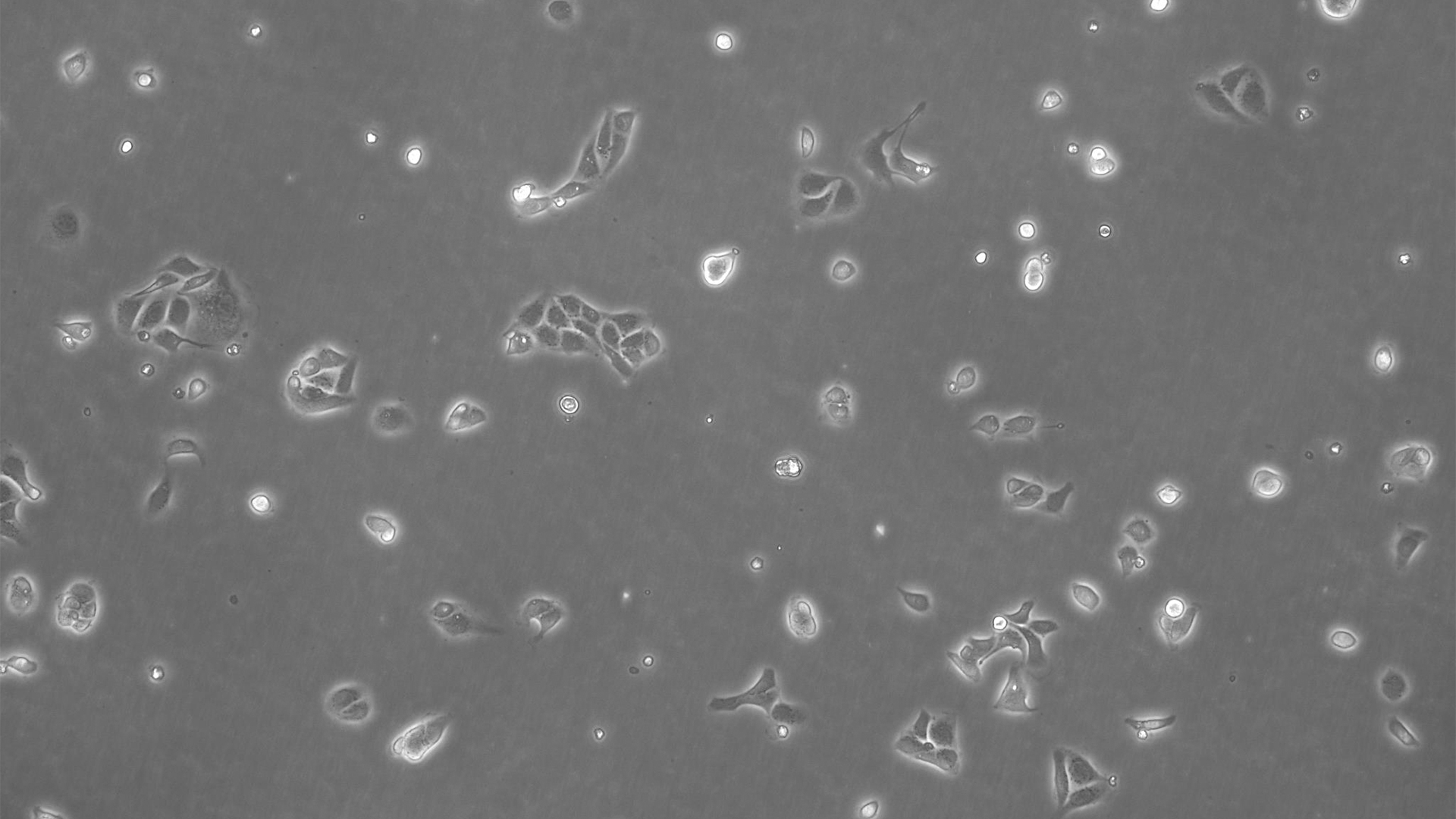
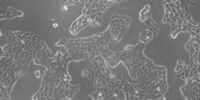
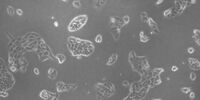
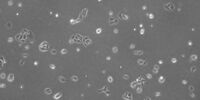
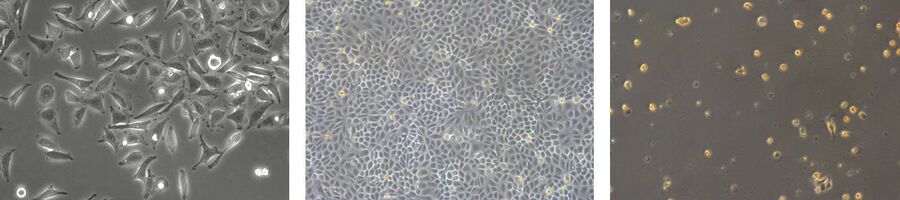
我们的细胞培养应用解决方案专家将竭诚为您提供建议.
{{ question.questionText }}
请选择一个答案!
最佳匹配
{{ resultProduct.header }}
{{ resultProduct.subheader }}
{{ resultProduct.description }}
{{ resultProduct.features }}
索取您的信息包
细胞培养产品
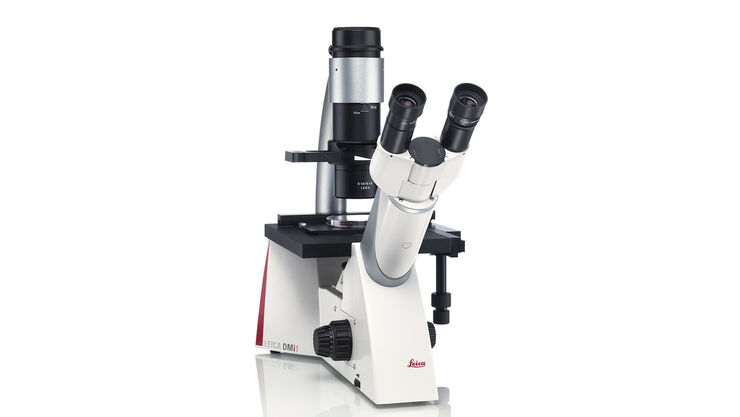
倒置显微镜:专为细胞和组织培养而设计 Leica DMi1
徕卡DMi1倒置显微镜支持您专属的工作流程。操作直观,灵活自如,使您可以完全专注于您的工作。根据需要,选择功能,如有必要,您还可以轻松添加必须的各种配件。
徕卡DM IL LED倒置实验室显微镜 Leica DM IL LED
徕卡 DM IL LED 提供各种不同的对比方法,方便您按需成像、观察样本。 只需几步操作,即可获得高质量相差成像、出色的调制反差成像和清晰的荧光成像。 稳定性高、操作空间充裕、适用大型培养瓶的更长工作距离、照明稳定且不发热,让显微镜成像更加轻松便捷。
数字透射光倒置显微镜 Mateo TL
对于需要一致实验结果的研究人员来说,Mateo TL使实验室所有成员都能方便、舒适地检测和记录细胞生长状态。一致地测量细胞融合度,从而增强对下游实验成功的信心。
明场 | 相差 | 微分干涉相差 (DIC) | 整合调制相差 (IMC) | 荧光 | 放大倍率 | 工作距离 | 摄像头 | |
Leica DM IL LED | + | + | - | + | + | PH: 5x to 63x IMC: 10x, 20x, 32x, 40x | 40 mm, 80 mm | + (自由选择) |
Leica DMi1 | + | + | - | - | - | 10x, 20x, 40x | 40 mm, 50 mm, 80 mm | + (集成式) |
Mateo TL | + | + | - | - | - | 4x, 10x, 20x, 40x | 50 mm | + (集成式) |
Mateo FL | + | + | - | - | + | 2.5x, 4x, 5x, 10x, 20x, 40x, 63x | 50 mm | + 双摄像头 (集成式) |
细胞培养实验室专用的显微镜。
显微镜 – 高级要求
我需要哪种工具?
一种很常见的细胞生物学科研手段是使用荧光标记转染细胞,以便使用研究型显微镜进行后续研究。如果您使用荧光蛋白,您的细胞培养显微镜还需要配备荧光选件,以用于控制转染效率。
为实现重要的记录和标准化目的,显微镜应配备数字摄像头,最好能够记录和梳理拍摄的数据。
由于细胞培养实验室都存在空间问题,细胞培养显微镜的尺寸不宜过大,例如,最好能安装在超净台中。此外,最新趋势都要求显微镜设计得足够小巧和稳固,以便在培养箱内部使用。
不管是精确跟踪培养皿中单个细胞的发育,筛选多个分析,获取单分子级的清晰度,还是梳理复杂过程的行为,DMi8 S 系统都能让您看得更多、看得更快,让您发现隐藏的信息。
细胞培养常见问题
徕卡显微镜均采用模块化设计,以最适合您既定需求或应用的配置发货。如果您后续需要更换,您始终可以通过添加可用的配件升级您的工作站。
徕卡显微系统可提供免费的Store & Recall软件(与面向工业领域的LAS X软件平台一同提供),允许您定制显微镜功能,并根据每名个人用户的要求和需求进行调节。该软件还允许您恢复所有与采集的图像一起保存的系统设置。
我们的所有编码显微镜解决方案均提供校准和成像对比。另外,徕卡显微系统还提供免费的Store & Recall软件,允许您恢复所有与采集的图像一起保存的系统设置。
不用。安装FLEXACAM C1相机,即可直接将图像保存在IT网络服务器上或USB存储器中。您还能以电子邮件的方式通过网络发送图像,无需连接PC设备。
使用FLEXACAM C1相机,您可以直接将图像保存在IT网络服务器上或USB存储器中。您还可以通过电子邮件发送图像,无需使用计算机。
有许多配件可供选择。请与您当地的徕卡销售代表联系。
徕卡光学显微镜有许多符合人体工程学的配件。请联系您当地的徕卡销售代表了解更多详情,或访问:体视显微镜的人体工程学配件
LAS X软件仅可在Windows系统下运行,但是对于MAC系统,我们有一个名为Leica Acquire的专用工具,您可以从苹果商店免费下载:
https://apps.apple.com/it/app/leica-acquire/id733706983?mt=12
不过,目前没有兼容Linux系统的软件。
是的,可使用第三方软件:https://www.splashtop.com/classroom
我们有可用于所有C型接口兼容相机的适配器。
兼容iOS或ANDROID操作系统的免费软件AirLab允许用户立即共享图像、视频和备注。
复式显微镜使用光学器件产生样品的放大图像,以便能够观察到裸眼无法检测到的细节。复式显微镜最基本的光学器件包含至少2个透镜:i) 位于样品附近的物镜,可产生放大的真实图像;ii) 用于查看样品真实图像的目镜。在通过目镜观察的用户眼中,样本就是他/她视网膜上的虚像。想了解更多信息,请参阅Science Lab文章:光学显微镜——基础知识
任何类型的光学显微镜所能大道的最高有效放大倍数取决于显微镜的最终分辨率或最大分辨率。分辨率则取决于显微镜物镜的数值孔径(NA)。低放大倍数下,NA小会导致分辨率低。高放大倍数下,NA高会导致分辨率高。不过,由于NA的最大值有限制,约为1.3,因此传统光学显微镜的“有效”放大倍率范围限制约为1,800倍。如果数码显微镜相机在大型显示器上显示图像,就会出现超出有效范围的放大倍率,称为“空”放大倍率。在空放大倍率范围内,样品结构看起来会更大,但无法解析其他细节。想了解更多信息,请参阅Science Lab文章:注意“空”放大倍率:30,000:1的放大倍率到底意味着什么?
教程
如何对细胞培养进行快速正确的检测
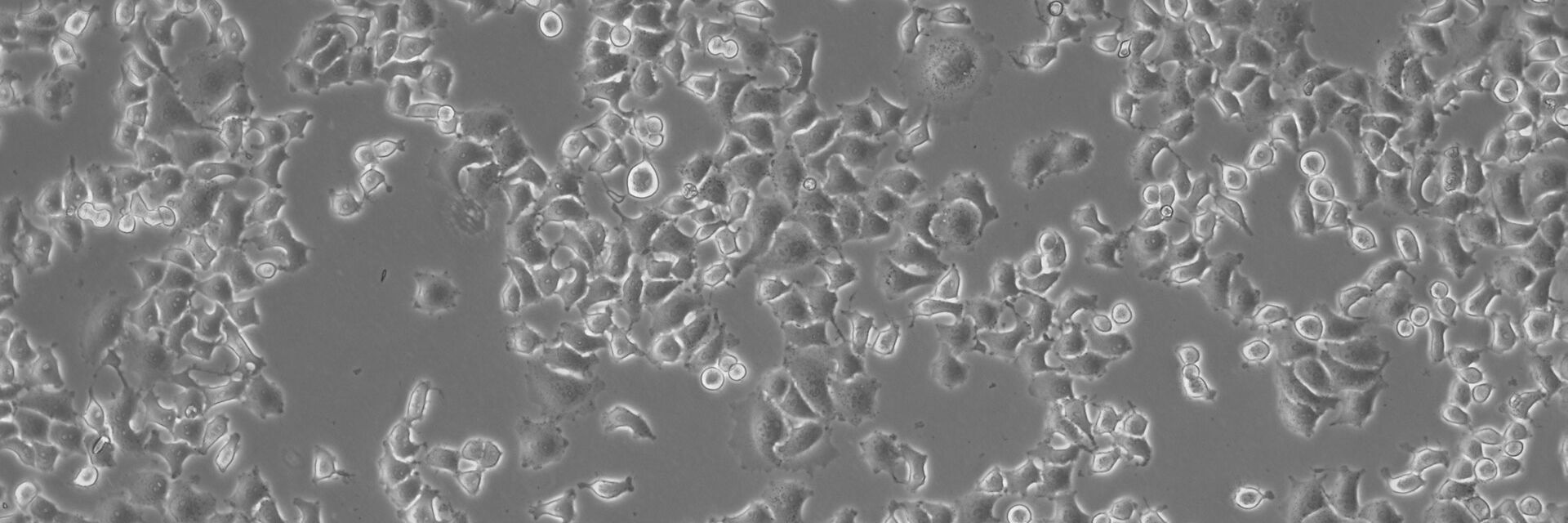
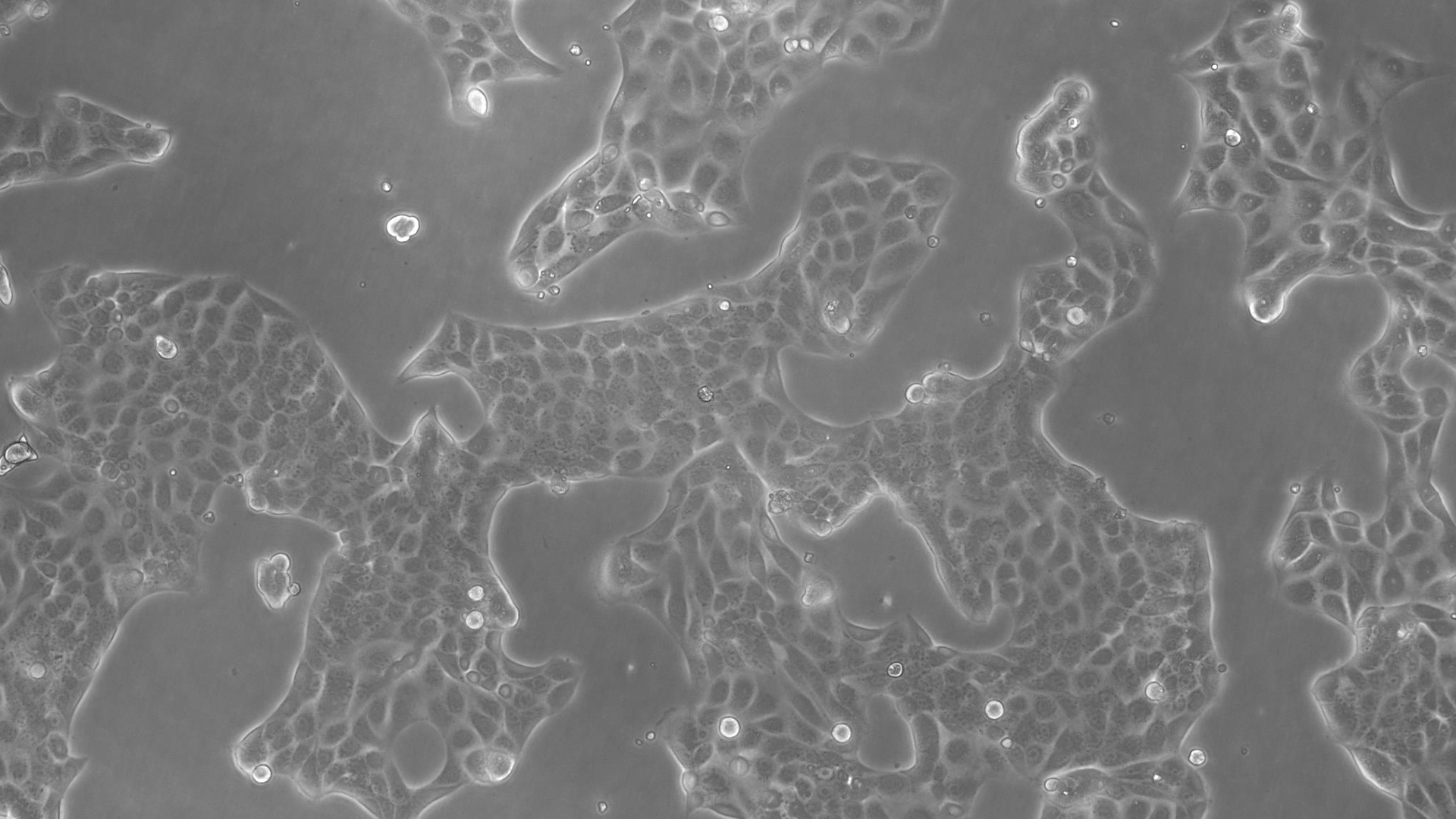
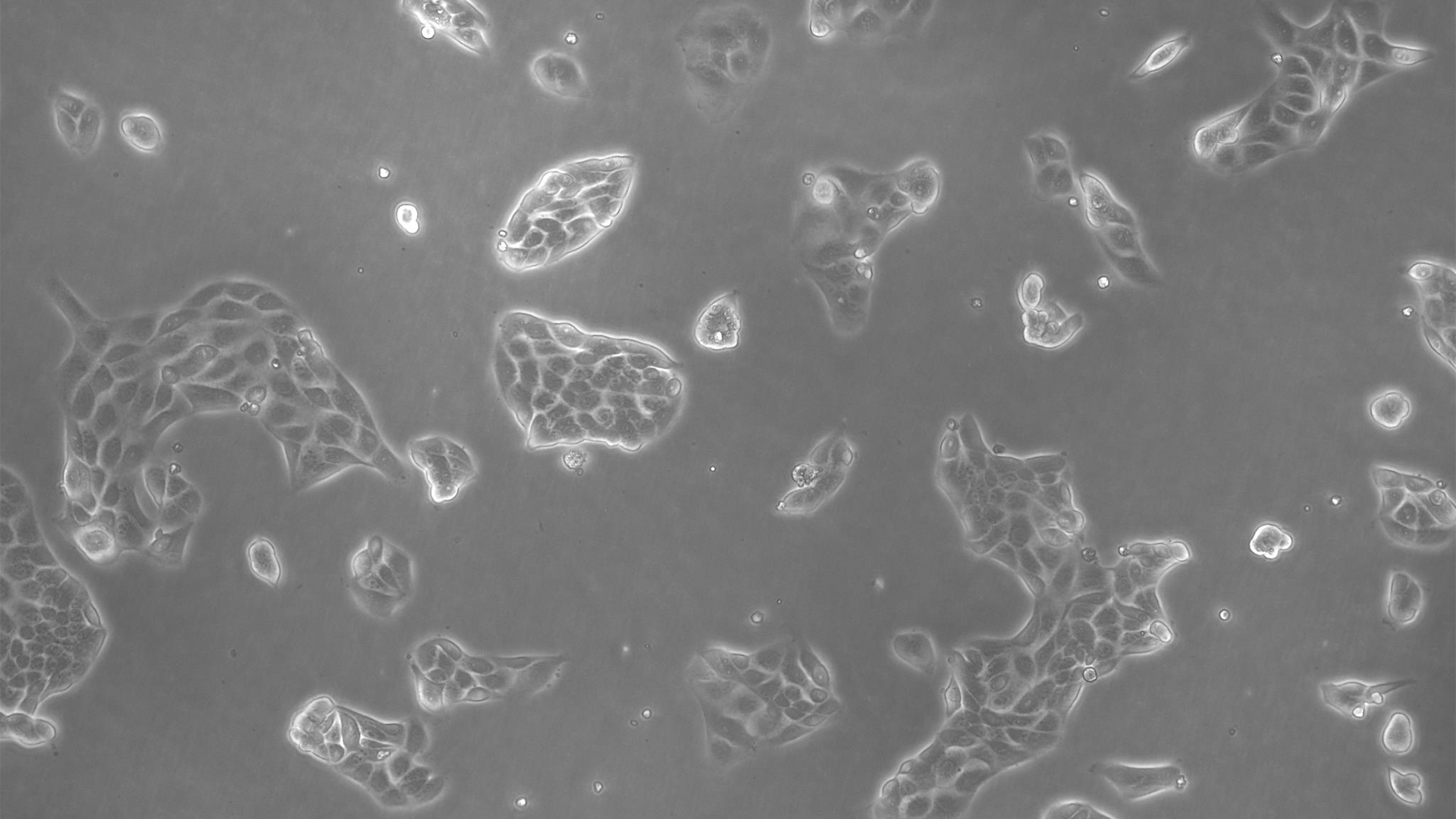
许多生物医学研究领域,如癌症研究、药物开发和组织工程,都需要使用活细胞来进行各种检测。哺乳动物细胞培养物是生物学中必不可少的工具,因为它们可以让不同类型的细胞快速生长和增殖,以便进行实验分析。
荧光蛋白
20 世纪 50 年代发现荧光蛋白后,荧光显微技术的前景发生了巨大变化。起点是下村修发现了维多利亚水母(Aequorea victoria)的绿色荧光蛋白(GFP)。数百个 GFP 突变体之后,荧光蛋白的光谱范围已从蓝色扩展到红色。
荧光简介
荧光是George Gabriel Stokes于1852年首次报道的一种现象。他观察到萤石在紫外线照射后开始发光。荧光是光致发光的一种形式,是指一种材料被光照射后会发射出光子。发射光的波长比激发光更长。这种效应又称为斯托克斯位移。