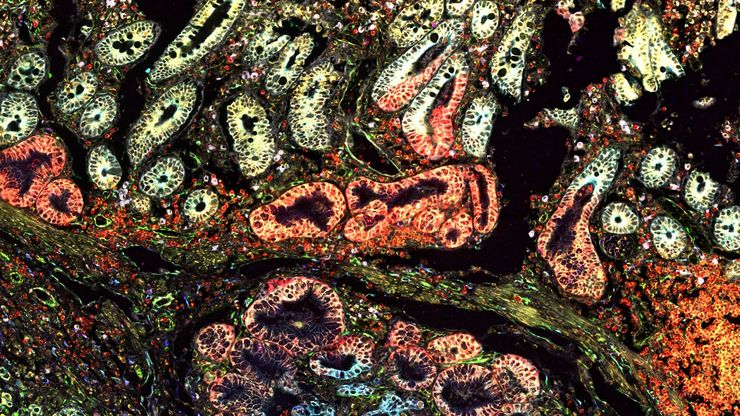
人工智能与深度视觉蛋白质组学 (DVP) 相结合,推进疾病研究
在这次网络研讨会上,Andreas Mund 博士将介绍深度可视蛋白质组学(DVP)--一种将人工智能驱动的组织空间分辨、非靶向蛋白质组学相结合的尖端平台。他展示了 DVP 如何从最小的、表型匹配的细胞群中识别数千种蛋白质,并在复杂的临床组织样本中生成高分辨率分子图谱,从而在细胞水平上解码疾病机制。
利用激光显微切割发现生物标记物
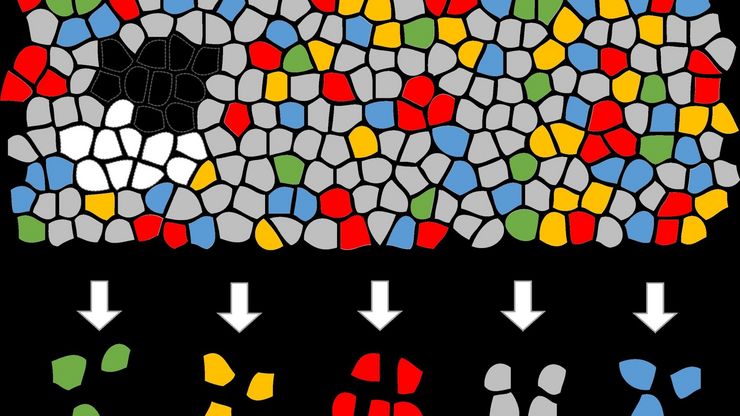
探索空间蛋白质组学工作流程的潜力,如深度视觉蛋白质组学(DVP),以破译病理机制和发现药物靶点。蛋白质表达、丰度或活性的改变会严重影响细胞功能--通常会导致疾病。值得注意的是,相邻细胞之间的蛋白质组可能存在巨大差异。空间蛋白质组学关注到这种细胞异质性,从而揭示了病理机制。激光显微切割技术(LMD)可获取单细胞进行下游分析,同时保留其空间环境,为空间蛋白质组学奠定了基础。
空间蛋白质组学的突破如何拯救生命
中毒性表皮坏死溶解症(TEN)是一种罕见的、但对抗生素或痛风治疗等常见药物的破坏性反应。这种疾病开始时并无大碍,通常只是皮疹,但会迅速升级为大面积皮肤脱落,类似于严重烧伤。尽管 TEN病情十分严重,但其基本机制仍然难以捉摸,治疗方案也仅限于支持性护理。TEN 的死亡率高达 30%,长期以来一直是临床医生的噩梦,直到现在才有了靶向疗法。
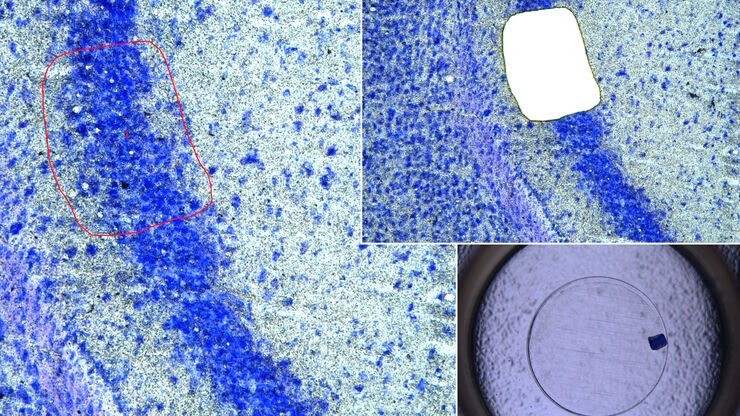
基于激光的视神经再生研究新方法
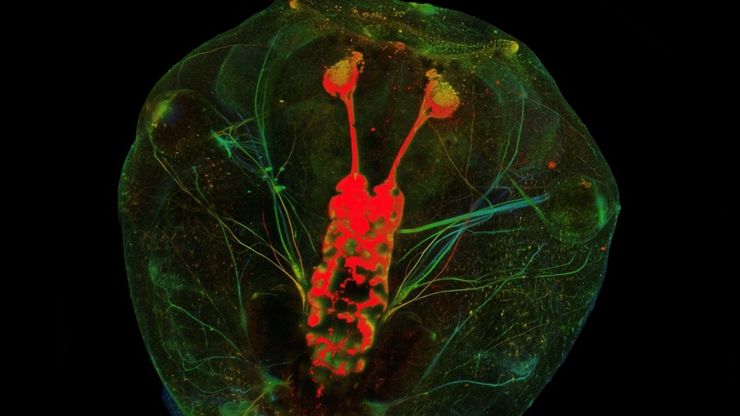
由于哺乳动物中枢神经系统(CNS)的自我修复能力有限以及传统损伤模型的不一致性,视神经再生是神经生物学的一大挑战。相比之下,爪蟾蝌蚪的视神经在受伤后可以再生,因此是研究轴突再生的分子和细胞机制的理想模型。在本应用说明中,我们展示了如何利用激光显微切割技术(LMD)对蝌蚪的视神经进行精确、一致的横切,从而开发出适合成像、转录组分析和功能恢复研究的高重复性损伤模型。
利用空间蛋白质组学工作流程改革研究工作
空间蛋白质组学是《自然-方法》2024 年度方法,正在推动癌症、免疫学等领域的研究进展。通过将定位数据与组织中蛋白质的高通量成像结合起来,研究人员可以发现疾病进展和治疗反应方面的洞察力,从而更好地了解人类生物学。在这里,您可以了解更多有关空间生物学的信息,以及徕卡显微系统的工具如何推动蛋白质生物标记的可视化和分析取得进展。
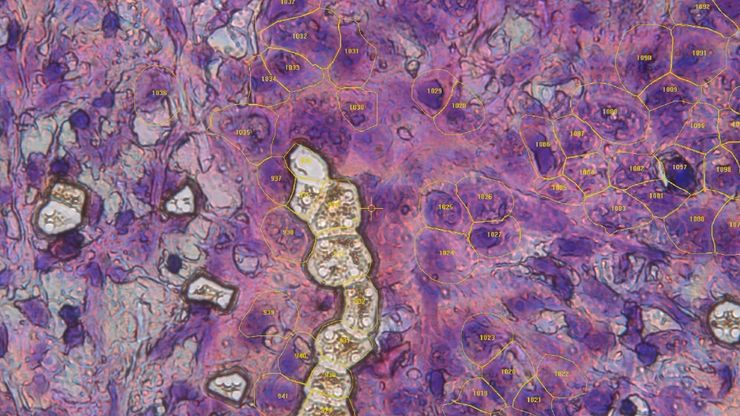
深度视觉蛋白质组学提供精确的空间蛋白质组信息
尽管可使用基于成像和质谱的方法进行空间蛋白质组学研究,但是图像与单细胞分辨率蛋白丰度测量值的关联仍然是个巨大的挑战。最近引入的一种方法,深层视觉蛋白质组学(DVP),将细胞表型的人工智能图像分析与自动化的单细胞或单核激光显微切割及超高灵敏度的质谱分析结合在了一起。DVP在保留空间背景的同时,将蛋白丰度与复杂的细胞或亚细胞表型关联在一起。
空间生物学指南
什么是空间生物学?在后组学时代,研究人员如何利用空间生物学工具来满足生物学问题日益增长的需求?本文简要概述了空间生物学及其技术,以及这一快速发展中的领域的关键研究问题。
激光显微切割技术导论
组织学和生物学样本的异质性通常要求在分子生物学分析前从周围组织中分离出特定的单个细胞或细胞群。激光显微切割(LMD)是一种高效选择性收集用于制备DNA、RNA、蛋白质或其他生物材料样本以供分析的方法。这是一种显微镜控制的操纵技术,利用聚焦激光束精确分离样本、细胞和组织。本文阐述了LMD的基本原理。
激光微切割(LMD)促进的分子生物学分析
使用激光微切割(LMD)提取生物分子、蛋白质、核酸、脂质和染色体,以及提取和操作细胞和组织,可以深入了解基因和蛋白质的功能。它在神经生物学、免疫学、发育生物学、细胞生物学和法医学等多个领域有广泛应用,例如癌症和疾病研究、基因改造、分子病理学和生物学。LMD 也有助于研究蛋白质功能、分子机制及其在转导途径中的相互作用。