Caspase测定法
Caspase检测可以研究细胞凋亡的早期阶段。在这里,我们研究了caspase-3和capase-7被细胞毒性药物(如星形孢菌素)激活的剂量依赖性。为了消除随机效应,在相同的条件下用不同浓度的一种药物或多种药物的组合,对多个检测样本进行了研究。具有统计学意义的结果通常需要重复实验数次。
Caspase检测中的挑战
caspase检测透露的主要是caspase激活级联开始时的信息。然而,关于单个细胞的其他形态学或激活反应的问题仍未得到解答。Caspase检测中加入更多的荧光染色剂可以获得更多的信息,例如在凋亡过程中的细胞骨架行为或细胞色素c介导的凋亡小体的组装导致caspase-3和caspase-7切割途径的激活[8]。在caspase检测中要快速收集所有荧光标签的信号,从而实现在规定时间间隔获取整个样本板上的数据,可能是很困难的。其次,很难快速并可靠地分离多达四个荧光标签的信号。最后,如果数据的获取与caspase活性的检测不是同步的,它们就不直接相关。
由于这些挑战,在进行caspase测定,特别是在结合额外的标记以获得更多信息时,常常会有一些担忧。激活反应前后和形态学数据可能会丢失或没有时空即位置和时间方面的相关性。另外,荧光标签之间的串扰也会导致对结果的误解。
目前,大量的研究实验室可能没有现成的用于这些检测工作的所有仪器和显微镜。这个问题通常通过使用多个研究小组和用户的共享设备来解决,但这意味着可能需要很长时间才能获得所需的仪器。
这些挑战可能导致延迟获得重要的、可量化的结果,而这些结果会影响根本性突破和获得新的见解。
Mica介绍
Mica是全场景显微成像分析平台,它将研究人员需要的一切都统一在一个完全可控的、高度灵活的环境中,加速显微镜的工作流程,以便更快地获得有意义的科学结果。通过使用这个显微成像分析平台,您可以从以下方面受益:
- 人人皆享:即使是没有经验的用户也能用MICA轻松设置复杂的检测读数。
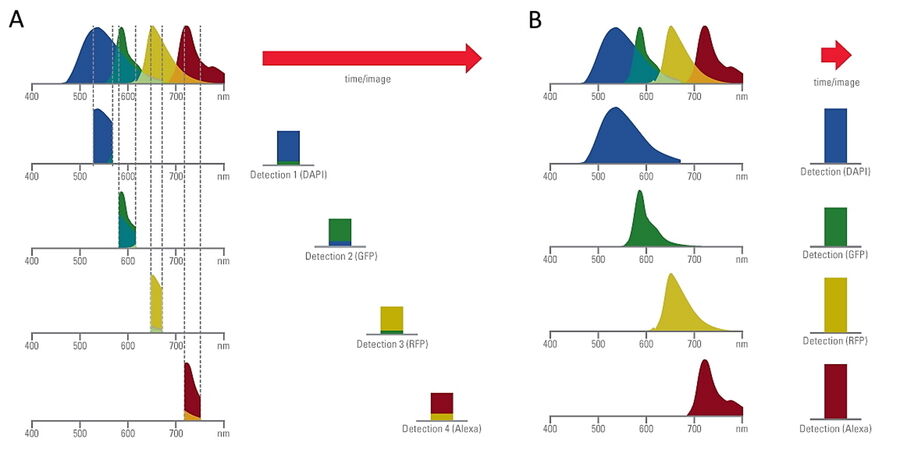
- 触手可及:MICA使得用户能同时对4个标记进行成像,具有100%的时空相关性。
-
极致简化工作流程:MICA对4个标记的同时采集以及后续AI驱动的数据分析都显著减少了工作流程步骤。
方法
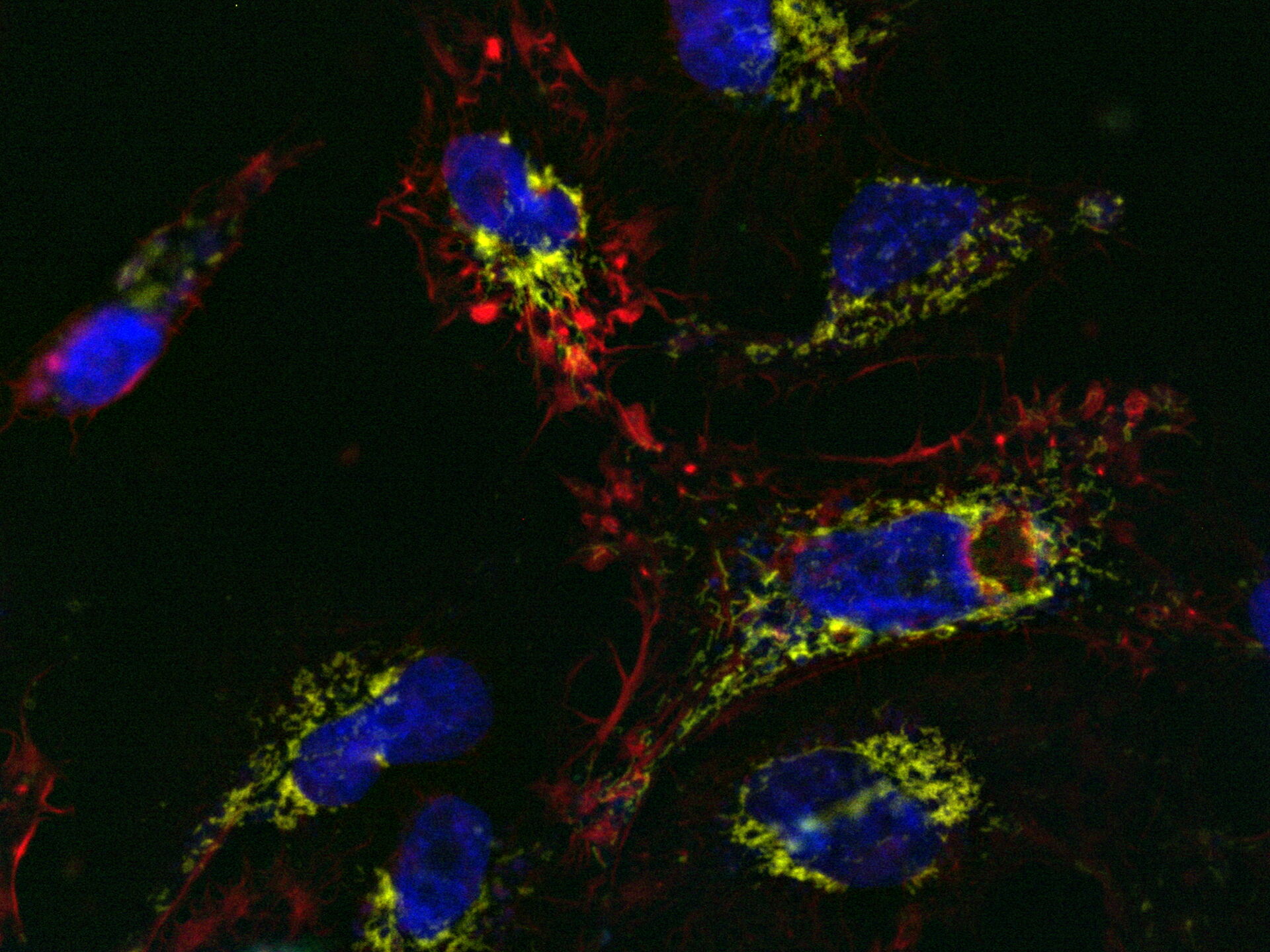
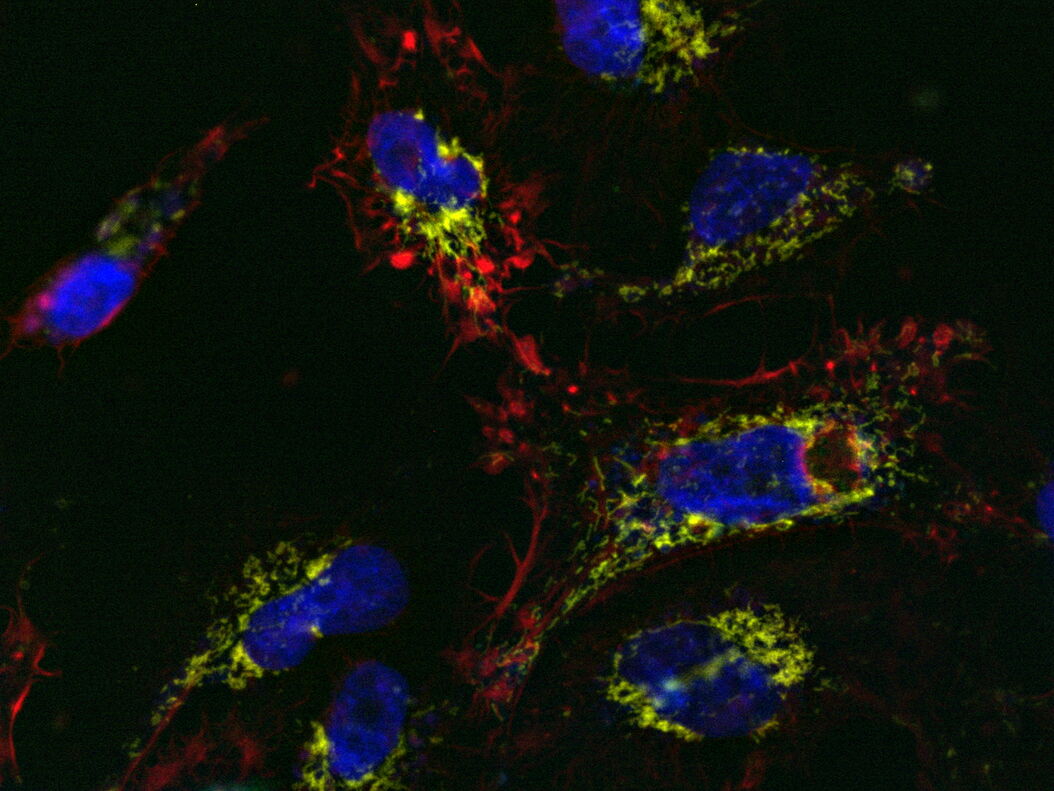
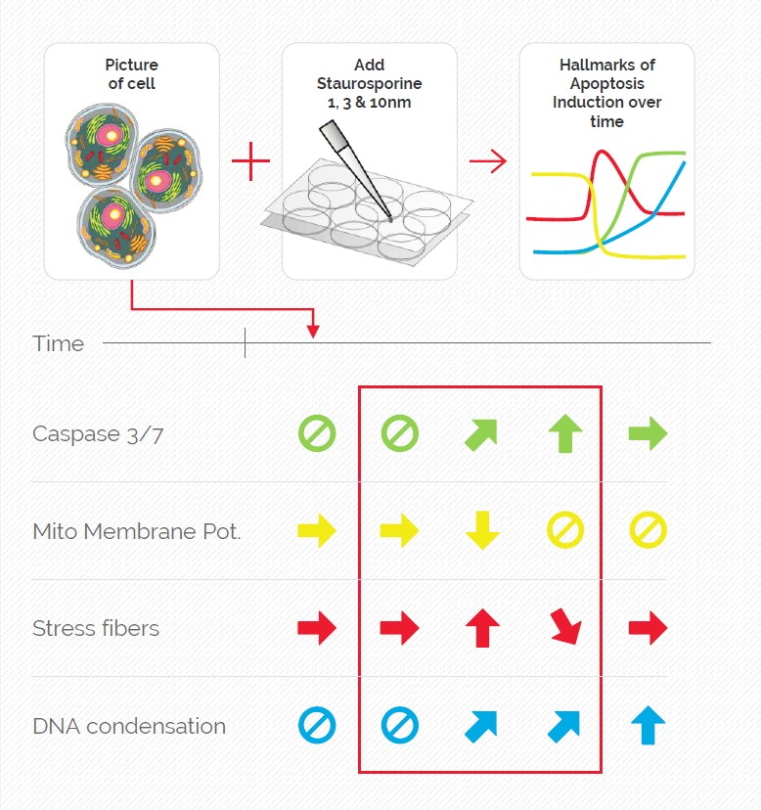
MICA用于荧光多孔板检测来研究caspase-3和caspase-7在激活凋亡中的作用(图1)。制备U2OS细胞相关样品,最后用星形孢菌素处理以诱导细胞凋亡。本实验有多个与凋亡早期阶段相关的读数。
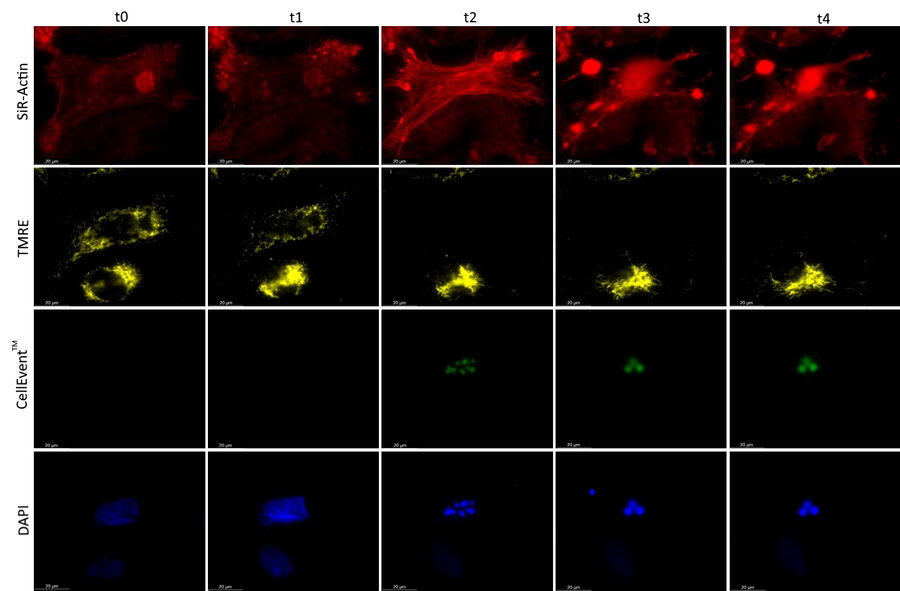
用MICA实现了4种荧光标记物的绝对时空相关性,由此可以对凋亡诱导的早期进行监测(参考视频1和图2)。观察到应力纤维的形成与caspase-3和caspase-7激活开始时线粒体膜电位的丧失相吻合。DNA凝结直接跟随caspase激活。
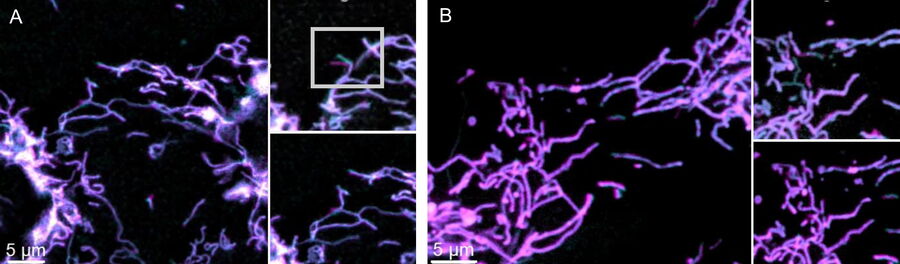
图3为传统宽场显微镜和MICA的时空多色采集对比。荧光标记的同步检测在研究线粒体动力学时,消除了观察线粒体结构和膜电位时的时空伪影。使用传统宽场成像时,由序列采集产生的时空伪影会使测量结果失真,并影响结构和功能的相关性。MICA的FluoSync技术能同时采集并确保时空相关性,采集时没有伪影,膜电位与线粒体结构正确相关。