以荧光为工具在显微镜中的应用
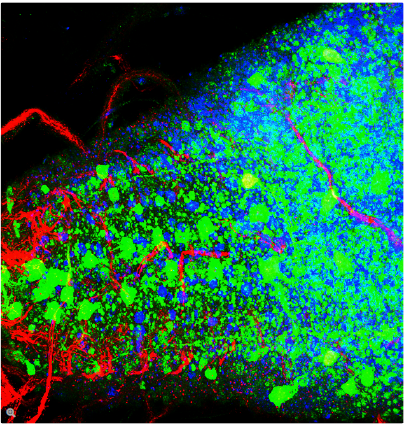
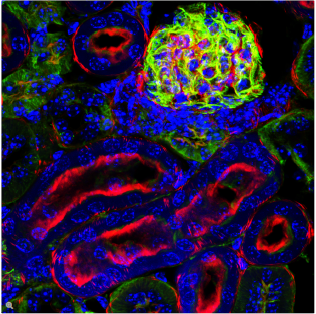
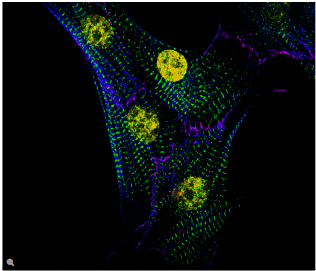
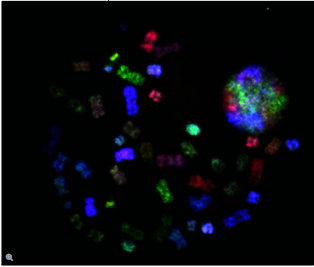
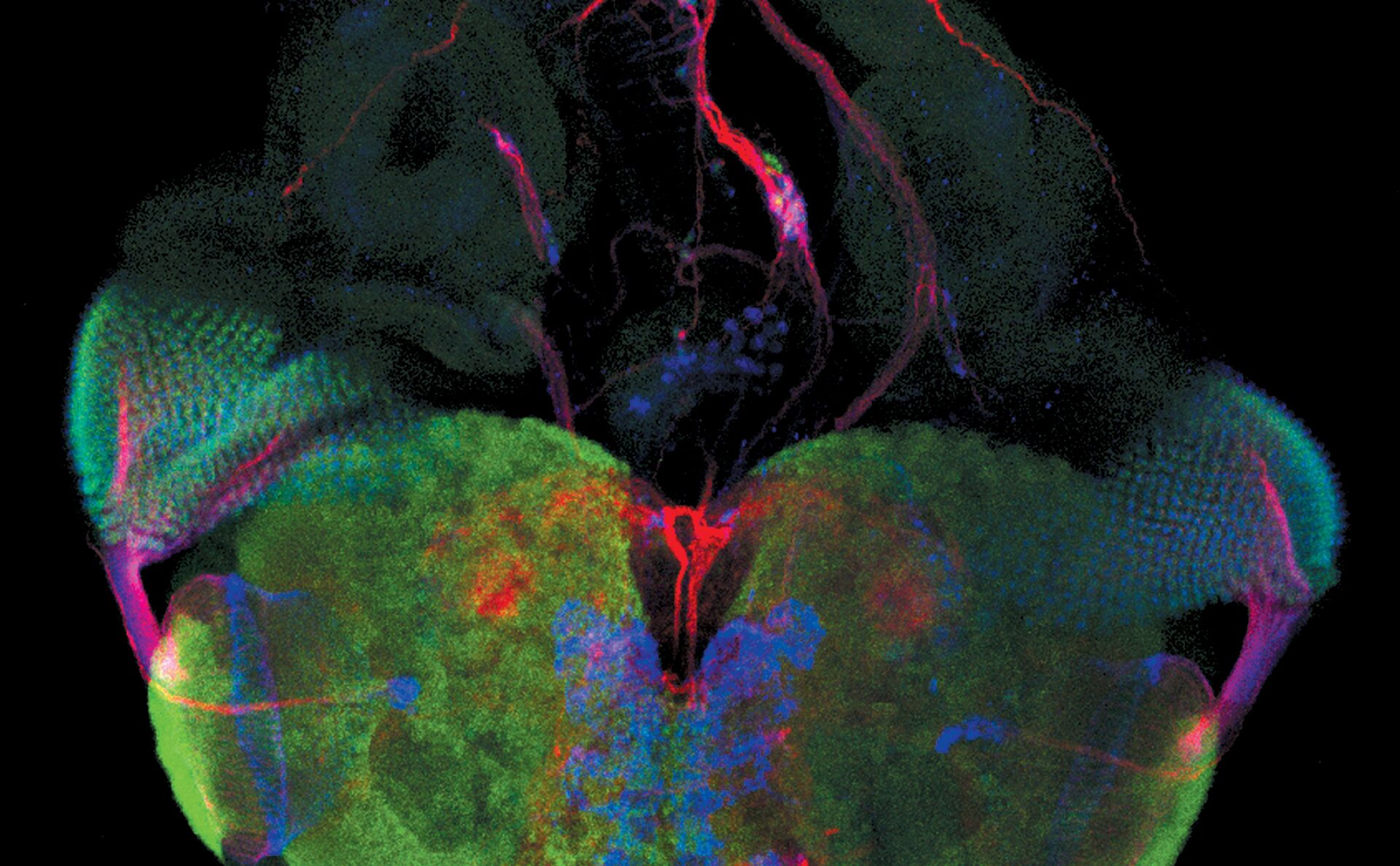
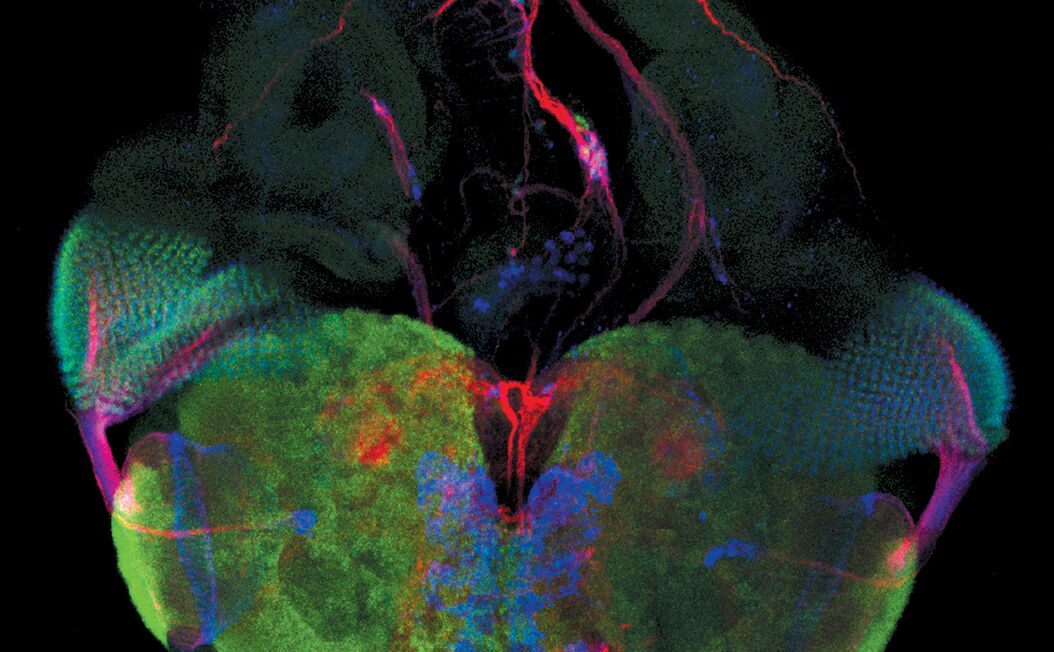
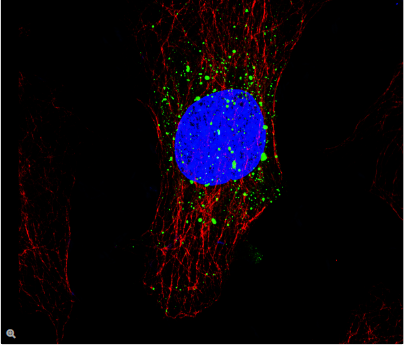
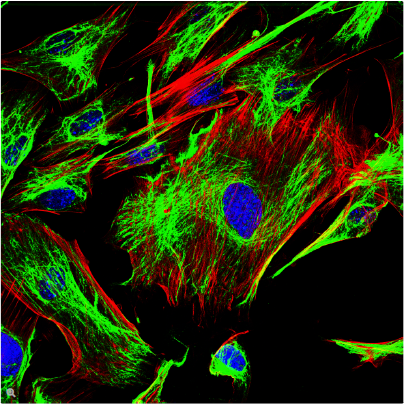
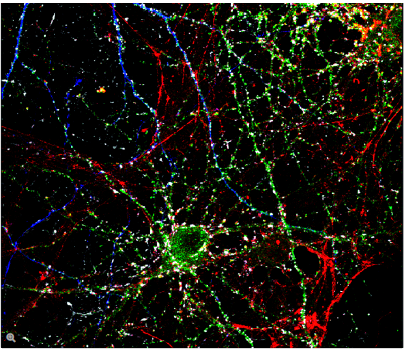
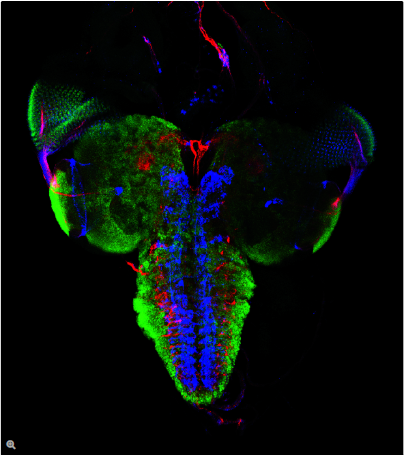
荧光在显微镜中有着广泛的应用,是观察特定分子分布的重要工具。细胞中的绝大多数分子并不会发出荧光,因此必须用荧光分子即所谓的荧光素进行标记。对于感兴趣的分子可以直接标记(例如,用DAPI标记DNA),或者使用可与特异性抗体偶联的荧光素进行免疫染色。免疫染色时通常必须对细胞进行固定。
荧光显微镜还可对活细胞或组织进行延时成像。为此,对于感兴趣的蛋白质可以使用基因编码的荧光分子进行标记,如GFP(绿色荧光蛋白)。对于感兴趣的分子(如Ca2+)还可以使用可逆结合的合成染料(如fura-2)或转基因天然蛋白质(如GFP衍生物)进行标记。
磷光的机制原理
由于磷光分子发光的时间比荧光素长得多,因此它们储存激发能量的方式肯定有所不同。这种差异的基础在于两种形式的激发能级,即单重激发态和三重激发态都基于不同的自旋排列。
自旋是电子的一种属性。简单来说,自旋描述了由电子旋转引起的角动量。电子的自旋方向可以是正方向(+1/2),也可以是负方向(−1/2)。更高能级的自旋配对可以在相互方向上平行或反平行。在反平行自旋配对中,单个角动量相互补偿,同时自旋总值为零。这种自旋排列就称为单重态。两种平行自旋互不补偿且所得数值不同于零值,在这种情况下,自旋被称为三重态。
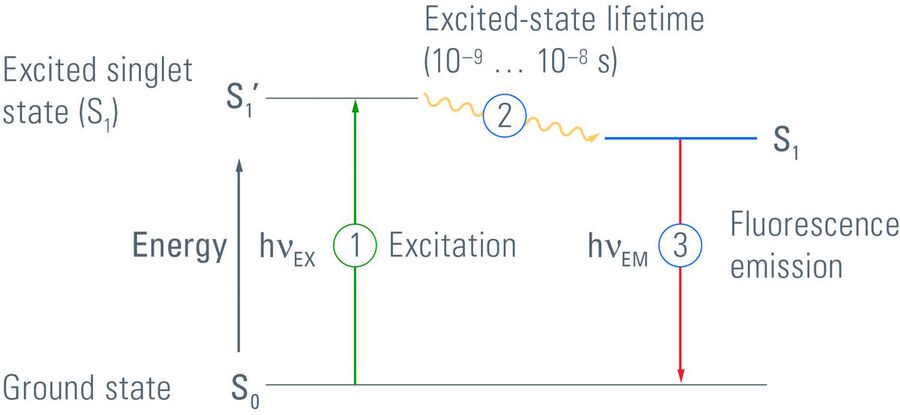
当电子从单重态激发态回到基态时,就会产生荧光。但在某些分子中,被激发电子的自旋可以在一种称为系统间交叉的过程中转换为三重态。这些电子失去能量,直到它们处于三重基态。这种态比基态具有更高的能量,但也比单重态激发态具有更低的能量。因此,电子无法切换回单重态,也不能轻易地返回基态,因为量子力学只允许自旋总值为零。因此分子被困在其能量状态当中。
但从三重基态到基态的一些变化有时还是有可能的。这些变化会发射出光子和磷光。由于一次只有少数事件可能发生,三重基态呈现为能量储库的形式,因此能够在更长的一段时间内发出磷光。
冷发光在显微镜中的应用
对于显微镜,荧光是最为实用的一种冷发光。荧光素可以很容易地通过特定的光源(如灯和滤光系统或激光器)在特定波长下激发,发射光和激发光可以通过波长来加以区分(斯托克斯位移)。
利用荧光成像,实验室人员可以对细胞内的分子数量和位置进行特征描述。荧光显微镜的另一个优点是可以同时使用几种荧光素。荧光素只需其激发和发射波长不同即可。因此,不同目标分子均可同时观察并开展大量的实验,例如开展共定位的研究等。