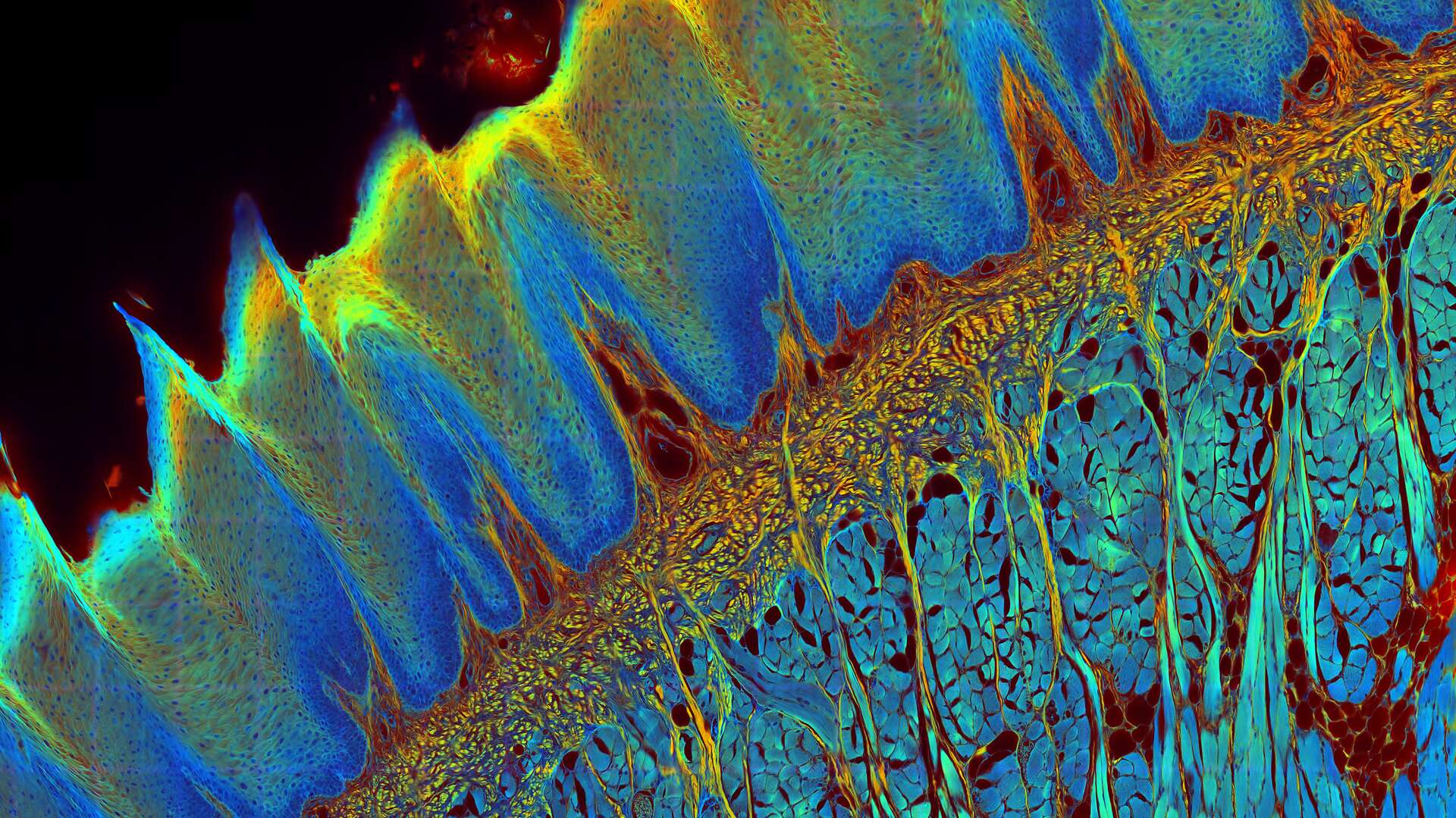
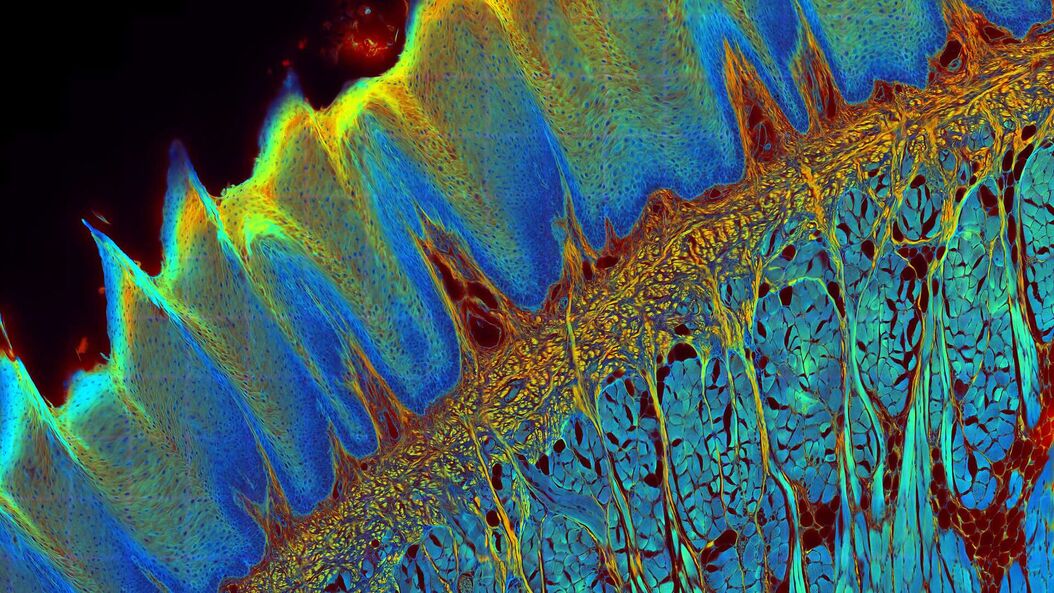
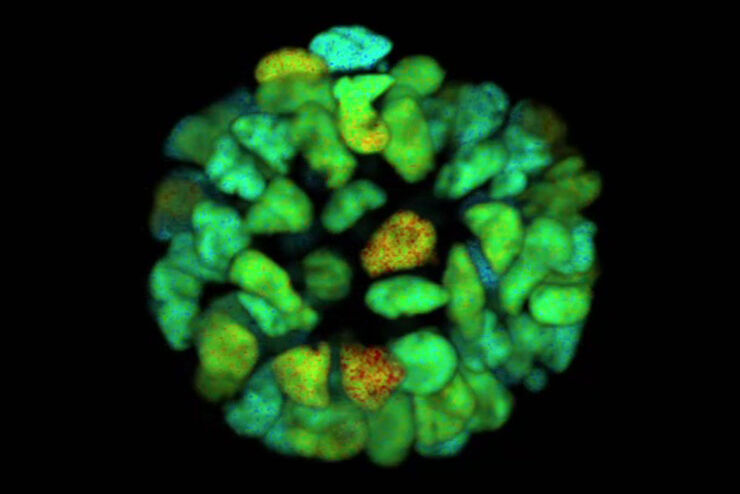
FLIM 方法
尽管绝大多数成像实验测量的是荧光的强度,但FLIM利用了荧光的另一个关键特性,为研究增添了丰富的信息来源——即荧光寿命。一种荧光染料具有特征发射光谱,同时也具有荧光寿命,后者反映了染料处于激发态的时间长短。FLIM图像的对比度取决于荧光信号的寿命,而非其强度。由于荧光寿命依赖于染料所处的微环境,因此这一信息能为实验提供一些有价值的全新见解。
直到最近,寿命成像仍被认为对于日常显微应用(尤其是涉及活细胞成像的应用)而言过于缓慢、复杂且昂贵。但这一切正在迅速改变。借助当今的先进技术,寿命成像正变得比以往任何时候都更快捷、更易于使用。
荧光寿命信息与荧光探针浓度无关,因此FLIM在研究分子功能、相互作用和环境方面,对于功能成像具有重要价值。FLIM还可结合生物传感器用于细胞微环境的研究。此外,FLIM可用于区分发射光谱重叠的荧光探针,并消除不必要的背景信号。
在本页面上,您将找到一份关于您可能对FLIM提出的各种问题的指南,并附有相关文章链接供进一步阅读。了解更多有关 FLIM 基础知识的信息
。FLIM 概述文章
一种新型荧光寿命成像概念:实现视频速率共聚焦FLIM
利用 FLIM 对细胞内温度进行成像
高端共聚焦显微镜中集成的精确且超快速光谱荧光寿命视频速率成像
什么是 FLIM - 荧光寿命成像显微镜?
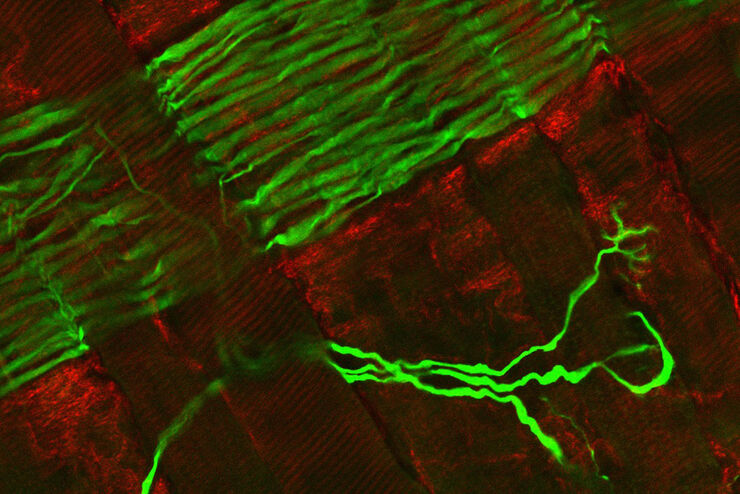
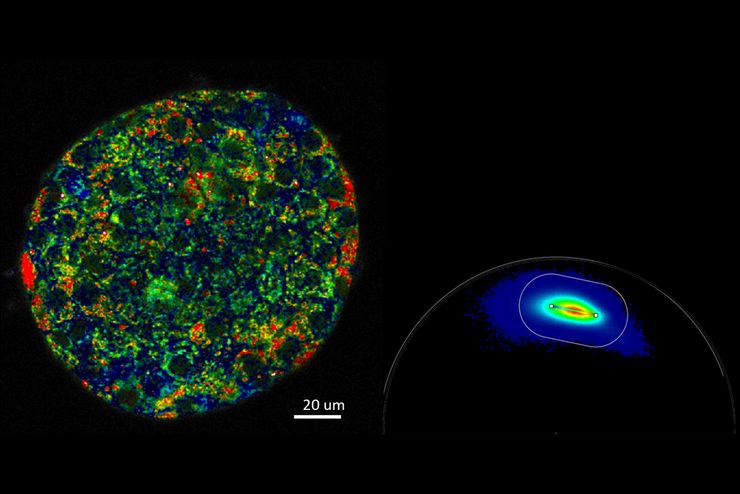
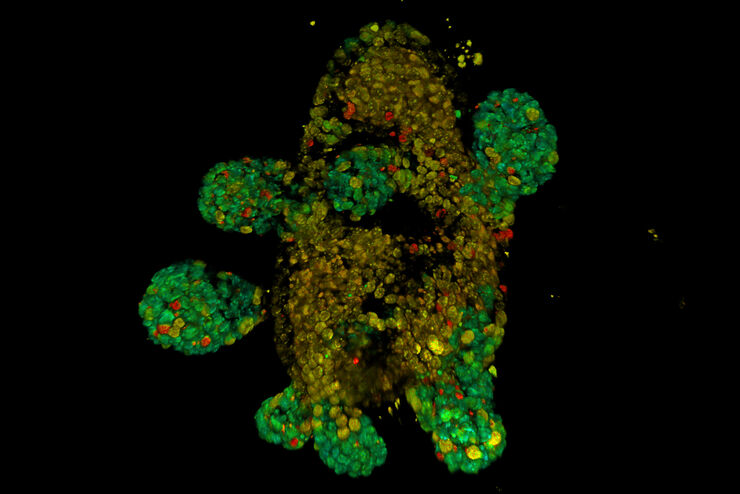
基于荧光寿命的成像图库
有哪些应用 FLIM显微镜?
FLIM 可提供仅有强度数据通常无法提供的信息。荧光寿命信息可帮助生命科学研究人员区分标本中的不同荧光团,即使它们的发射光谱相互重叠。与强度不同,荧光寿命与分子浓度无关,但它取决于染料的微环境,因此 FLIM 可以监测标本内局部环境条件的动态变化。
FLIM 可以帮助您获得新见解的一些常用应用包括
- 利用对环境敏感的荧光探针探索细胞微环境 ,这些探针可用于跟踪温度、离子浓度、pH 值、极性、粘度和次级信使的变化。
- 通过自发荧光鉴定各类组织的特征。
- 通过无标记实验分析活细胞、组织和生物体中的新陈代谢和线粒体功能障碍 利用无标记实验分析活细胞、组织和生物体的新陈代谢和线粒体功能障碍
FLIM 与佛斯特共振能量转移(FRET)相结合的生物医学研究应用 也有利于研究细胞的动态变化。FRET 可以监测配体与受体、蛋白质或效应物与 DNA 之间的分子相互作用。
最近利用荧光显微成像技术进行的糖尿病研究,研究了胰岛中的α细胞和β细胞功能障碍导致的正常血糖水平维持缺陷。 多光子相位-FLIMNADH 自发荧光成像技术用于检测葡萄糖刺激前后活体胰岛细胞的新陈代谢变化。在健康胰岛细胞中,葡萄糖刺激后相位荧光成像可观察到β细胞的氧化磷酸化增加和α细胞的氧化磷酸化抑制,但在2型糖尿病胰岛细胞中却观察不到这些变化。
FLIM 可以通过多种方法为您当前的共聚焦实验增加深度,包括减少图像中出现伪影的几率、区分真实信号和不需要的自发荧光,以及有把握地区分更多荧光团。
Flim 应用文章
相位荧光成像检测代谢差异
获取干细胞的代谢信息
活体 T 细胞上的 HIV-1 Env 三聚体结构动力学
为什么 FLIM 和 FRET 是如此完美的组合?
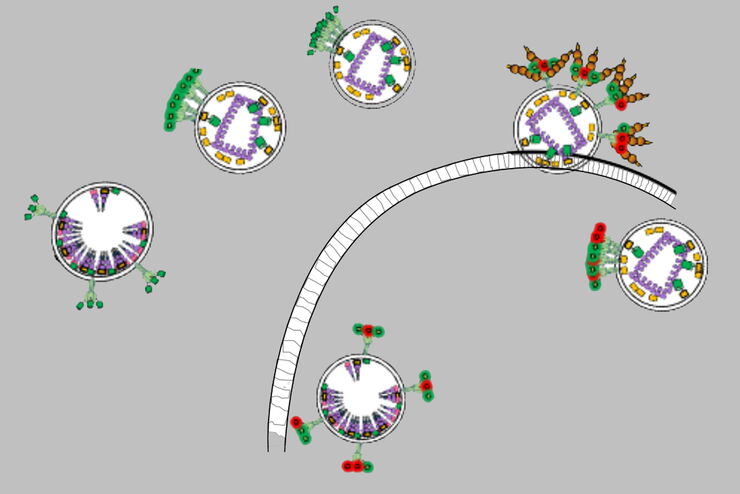
荧光是分子或原子在吸收光后被激发而自发发射光子的过程。如果两个荧光分子(荧光染料)彼此非常接近,仅相隔数个纳米,能量可直接从“供体”传递至“受体”荧光染料,而不会发生光的发射。这种直接的能量传递被称为弗斯特共振能量转移(FRET)。
FRET的发生可通过多种现象体现。首先,样品(受体)将发出一种无法由所用激发光颜色预期的荧光信号。该发射信号可被检测并与原始发射进行比较,此方法称为“敏化发射”。敏化发射可定量地反映FRET的发生。
另一方面,由于部分激发态会转移至受体,供体的发射信号将减弱。这一现象被应用于一种称为“受体光漂白”的方法中,即通过光漂白消除受体后测量供体发射信号的变化。当受体被去除后,供体的发射信号将增强。
荧光染料发射光谱的重叠程度越高,FRET发生的概率越大。分子的取向也会影响能量转移。FRET可用于检测和研究细胞内分子间的相互作用,例如配体与受体、蛋白质之间,或效应分子与核酸之间的相互作用。
基于强度的FRET方法对样品中荧光染料含量的变化、分子扩散、样品位移以及激发光波动等因素较为敏感。幸运的是,FLIM与FRET的结合在克服上述限制方面具有显著优势。当发生FRET时,供体的荧光寿命会出现明显缩短,甚至可作为FRET效率的衡量指标。更多信息 结合 FLIM 和 FRET.
徕卡显微系统公司的 STELLARIS 8 FALCON 为生物传感及蛋白质间相互作用的追踪打开了大门,现在所有成像模式均可提供FLIM信息。这一创新性集成系统使研究人员能够通过FLIM-FRET跟踪快速分子相互作用,利用生物传感器检测代谢状态和微环境的变化,并应用寿命对比技术分离多种荧光探针。此外,STELLARIS 8 FALCON解决方案使研究人员能够在极少培训的情况下获取FLIM数据。
该解决方案通过荧光寿命提供了新的图像对比度维度,从而实现生物传感,并借助FLIM-FRET监测即使是非常快速的分子相互作用。它还使研究人员能够利用生物传感器检测代谢状态和细胞环境的变化,并通过寿命信息区分不同的荧光探针。
采用FLIM相量分析可对寿命组分进行二维可视化。相量分析方法无需任何拟合过程。FLIM相量的图形化显示使观察者能够快速区分并分离不同的寿命组分,且分布解读直观明确。单个像素内即可分辨多种分子样本,因每种样本均具有特定的相量。FLIM相量可用来追踪细胞环境的变化、选择用于信号多标的组分,并测定FRET效率。
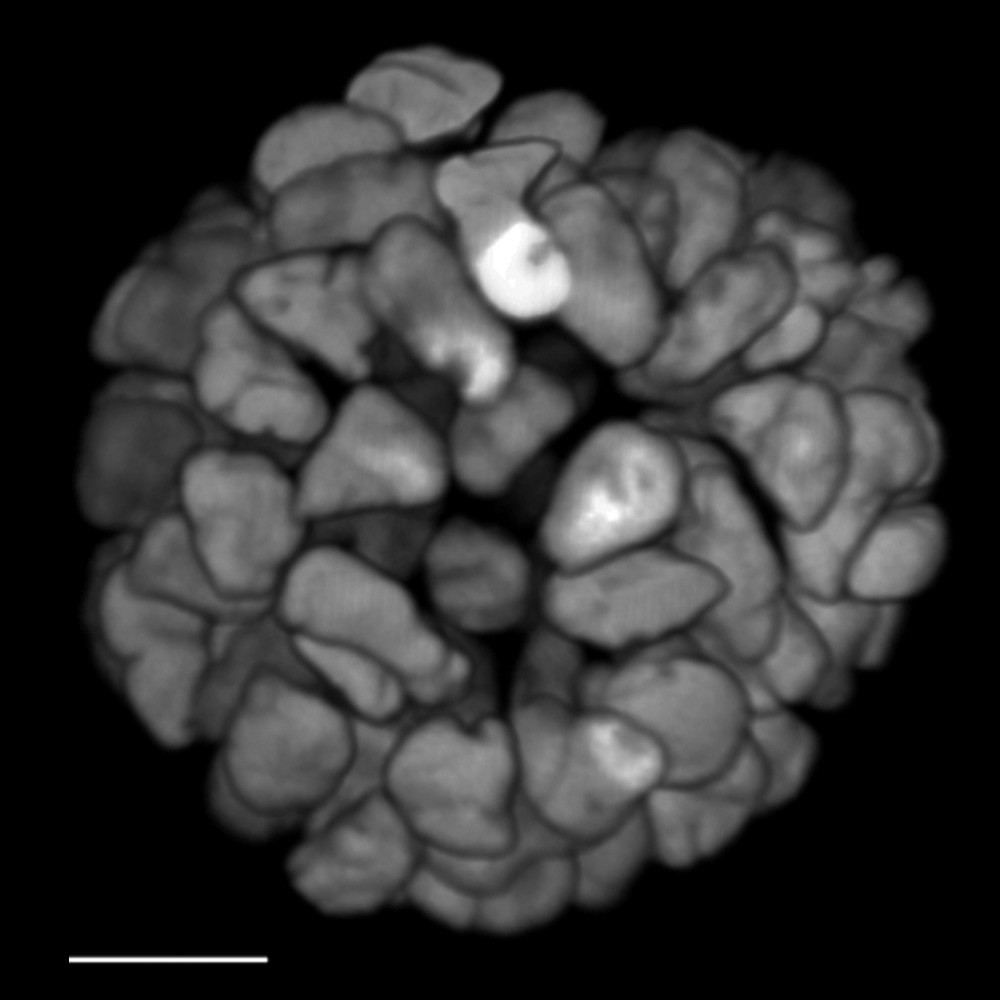
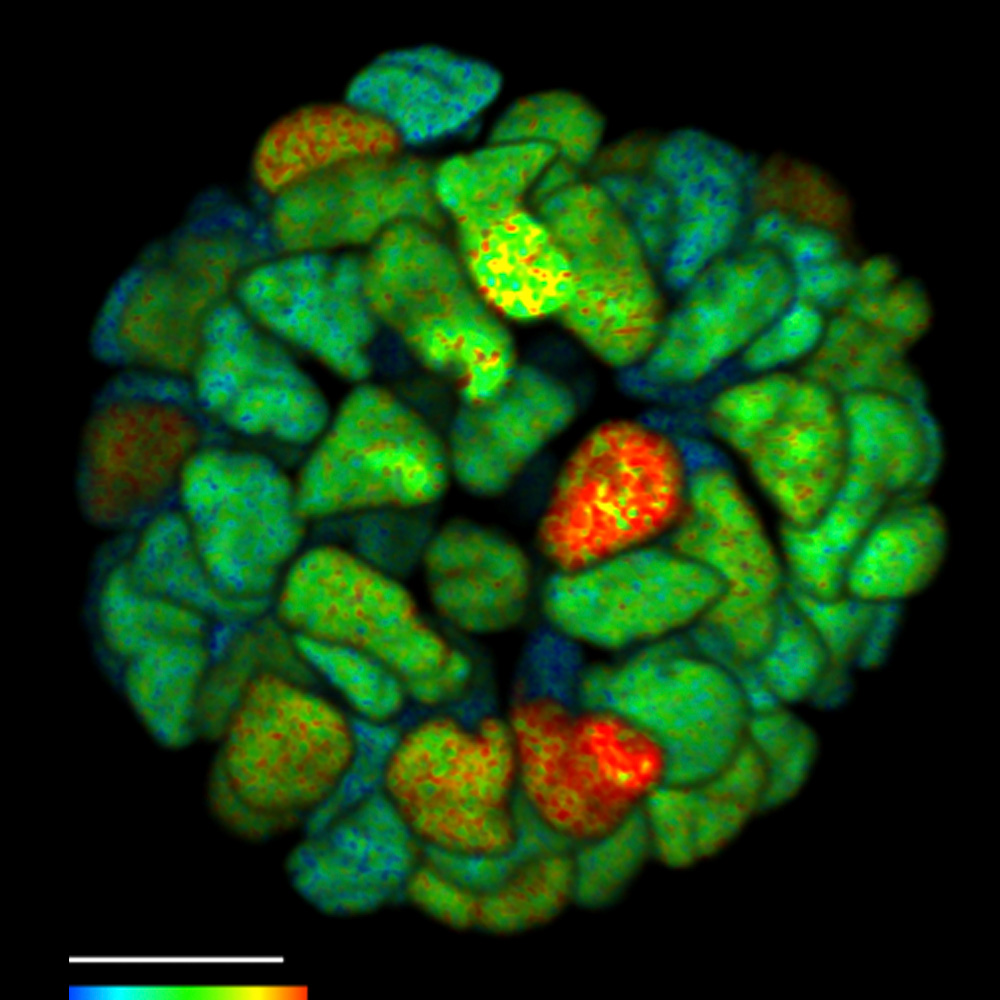
在活体三维癌症患者器官组织上进行 FLIM。利用 ERK FRET-FLIM 生物传感器监测活体器官中癌症衍生信号转导活性的增加。
FLIM 技术的最新进展是什么?
利用 STELLARIS 8 FALCON 系统的快速电子器件和灵敏的光谱混合探测器,可以实现逐像素量化的视频速率 FLIM。光子到达时间以标准共焦成像的典型计数率记录。该系统具有超短的死区时间和强大的内置算法,可用于数据采集和分析。传统的时间相关单光子计数(TCSPC)解决方案本身速度慢且难以实施,因此 FLIM 成像仅限于专家使用,无法提供研究生物过程所需的速度,研究速度无法超过数十秒。
为了获得快速结果,寿命成像已无缝集成到 STELLARIS 8 FALCON 平台的全光谱灵活共焦成像和处理工具中。寿命信息作为典型共焦图像的额外对比通道进行记录。因此,现在记录 FLIM 数据就像按下按钮一样简单。
STELLARIS独特的TauSense技术使您能够从每个样本中提取额外的信息,提高研究的科学影响力。TauSense由基于荧光寿命的应用导向型成像工具组成,您可以利用它来探索分子在细胞环境中的功能:
- TauContrast > 可获取代谢状态、pH 值和离子浓度等功能信息;
- TauGating > 可消除不必要的荧光贡献;以及
- TauSeparation > 将荧光信号的组合扩展到了光谱选项之外。
- TauInteraction > 直接检测和量化分子相互作用(如蛋白质-蛋白质相互作用)。
有关 Tausense 的更多详情,请参阅我们 在《Nature Methods》上发表的应用说明。
FLIM 常见问题
利用FLIM可以追踪细胞环境的动态变化。因此,蛋白质与其他生物分子(如配体、受体和核酸)之间的相互作用可在活细胞中通过FLIM进行监测。
FLIM可用于在样本成像过程中消除自发荧光背景。通过寿命测量,可以将自发荧光与目标荧光染料信号区分开来。这一能力使得FLIM能够从几乎所有荧光信号(甚至包括自发荧光)中提取有意义的信息。
生物医学研究者常希望监测活细胞中的离子、蛋白质、生物分子及其相互作用,以理解动态过程。相比基于荧光强度的方法,FLIM是研究细胞动态更优的选择。荧光寿命不受荧光染料浓度、照明强度以及光吸收和散射的影响。