简介
细胞神经科学的一个主要焦点就是突触的结构与其功能特性之间的关系。尽管我们对突触传递的了解已取得根本性进展,但许多问题仍未得到解答。中央突触的分子组成、结构和功能差异很大,因此,分析清晰易辨的突触对于解决这一知识空白至关重要。
电子显微镜(EM)提供了纳米等级的理想空间分辨率,但它的缺点是只能捕获静态图像。为了分析活体标本中的突触,经常会使用共焦、双光子和光学超分辨率成像。然而,这些方法经常用于分离培养的神经元,是一种简化的系统。此外,要达到足够的分辨率来识别单个活动区域或单个突触囊泡可能非常困难。解决突触结构和功能之间关系的最佳方法应该提供纳米级空间和毫秒级时间的信息。
以下描述了一种改进型“急速冷冻”技术。这种改进的成像方法可应用于急性切片和器官切片培养,以便在已识别的皮质突触中精确定义的时间点探测突触传递过程中的结构变化。由于使用了急性薄切片、改进的载体几何形状、恢复方案以及优化的冷冻保护和冷冻替代,这种改进可能实现。
作为概念验证,急速冷冻方法用于齿状回颗粒细胞和CA3锥体神经元之间的海马苔藓纤维突触,这是海马体三突触回路中的关键突触。苔藓纤维末端与独特形态的超微结构形成较大的突触接触,即存在大量的突触囊泡、不同的囊泡直径,以及致密的核心囊泡的存在。从生理学的角度来看,这种突触具有几个独家特性,包括低初始释放概率和突出的突触前可塑性。此外,冷冻法还可以成功用于小脑和脑干。
方法
转基因小鼠用来专门针对正在研究的突触前神经元。本例中,Prox1启动子用于针对齿状回颗粒细胞。对于光敏感通道蛋白的选择性表达,Prox1-CreERT2系小鼠与报告基因Ai32 (ChR2(H134R)-EYFP)系杂交。
免疫荧光和共聚焦显微镜用于通过EYFP表达验证颗粒细胞中的选择性表达。还进行了针对EYFP的免疫标记预嵌入实验,以使用电子显微镜检查选择性表达。
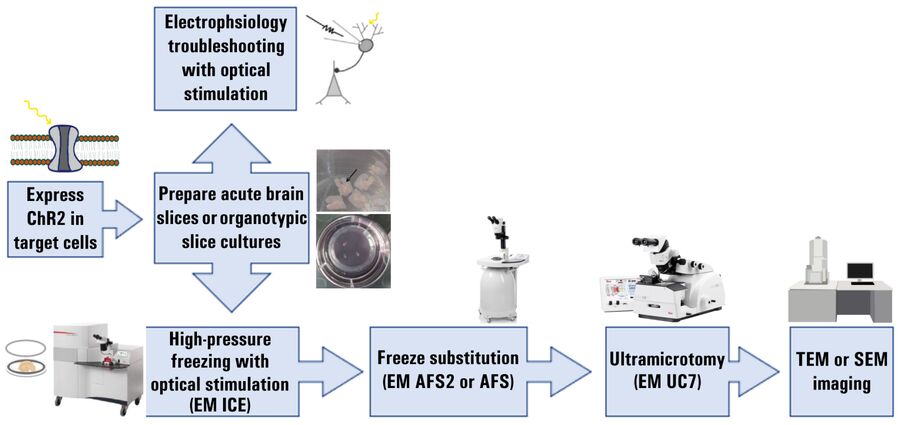
如前所述制备急性切片和切片培养物,以最佳保存海马苔藓纤维束[1],用于电生理学和高压冷冻 (HPF) 实验。
首先,在急性切片和切片培养中对具有光刺激的突触传递进行彻底的电生理学表征,以确定急速冷冻实验的最佳参数,例如脉冲持续时间和频率。注意确保刺激功率和强度与EM ICE高压冷冻仪相匹配。
显示改进后急速冷冻法工作步骤的实验工作流程如下图 1 所示。
结果
海马体颗粒细胞的选择性光激活和诱发对CA3锥体神经元的突触传递
为了在苔藓纤维 CA3 锥体神经元突触上进行功能性EM实验,首先要克服的挑战是颗粒细胞的选择性靶向和光学激活。使用Prox1启动子在颗粒细胞中实现光敏感通道蛋白的选择性表达。Prox1-creERT2系小鼠与Ai32(ChR2(H134R)-EYFP)报告基因系列小鼠杂交。通过荧光共聚焦显微镜和电子显微镜的预嵌入实验,通过EYFP免疫标记验证选择性表达。
接下来,通过急性切片和器官切片培养的电生理实验确定了光遗传技术刺激的最佳设置[1]。光脉冲的强度与HPF设备达到的强度相同。这些实验确定了用于颗粒细胞激活和动作电位诱发突触传递到CA3锥体神经元的最佳脉冲持续时间和频率。通过这种特殊的小鼠杂交,我们发现最佳参数是以最大20Hz的频率施加的5毫秒的光脉冲。
用于功能性EM的急性切片的高压冷冻 (HPF)
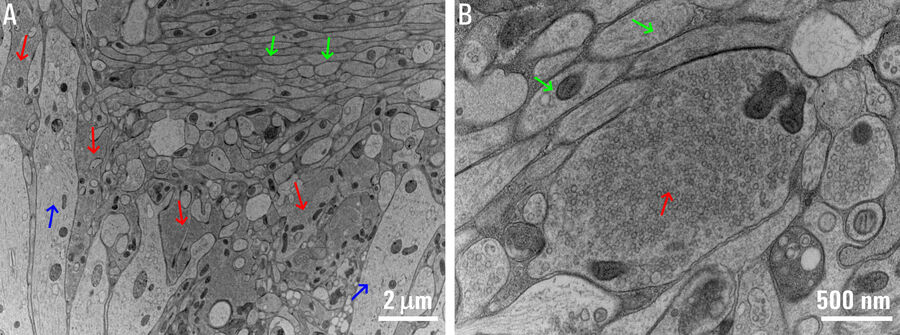
将HPF技术用于急性切片和器官切片培养,旨在通过急速冷冻实验检查处于原生网络环境中的中央突触,而冷冻实验需要进行一些改进,以便克服现有限制。此前已经开发出针对非固定器官切片培养物的标准HPF实验。因此,器官型切片培养物同时被用作优化急性脑切片HPF方法的参考[1]。HPF处理的急性切片的EM显微照片如下图 2 所示。
首先,用于HPF实验的急性切片制备工作与用于电生理学实验的切片制备工作尽可能相似。还有恢复期,这对神经元健康非常重要。其次,切片厚度范围为150到200微米。第三,使用带间隔环(外径为6毫米,内径为4毫米或5毫米)的大直径蓝宝石夹层。该夹层让整个切片制备被冷冻而无需进一步修剪,因此具有网络的整个目标大脑区域保持完整。第四,优化了冷冻保护的浓度和时间。切片始终保存在接近生理温度并浸没在人工脑脊液 (ACSF) 中,后者也用作填充介质。在关闭夹层之前,加入一滴含有15%聚乙烯吡咯烷酮(PVP)的ACSF作为冷防冻剂以防形成冰晶。最后,注意测试和开发优化的加速冷冻替代方案以获得最佳超微结构。除海马体外,该方法还成功应用于小脑和脑干区域。超微结构的分析重点是确定的活动区域和活动周边区域[1]。
这些改进有助于在急性切片中获取最佳保存效果的超微结构,可与用于HPF实验的高压冷冻器官切片培养物的超微结构相媲美,无需光遗传技术刺激。在没有刺激的实验控制条件下,对接囊泡池进行的分析表明,与器官切片培养物相比,急性脑切片中的囊泡数量更多、直径更高。
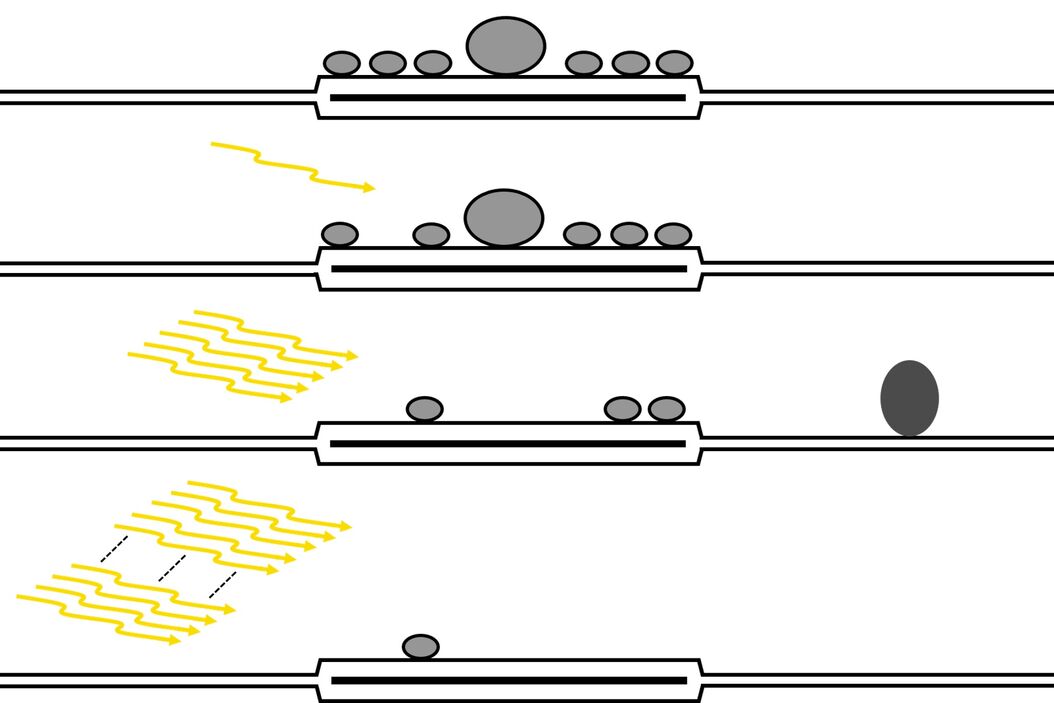
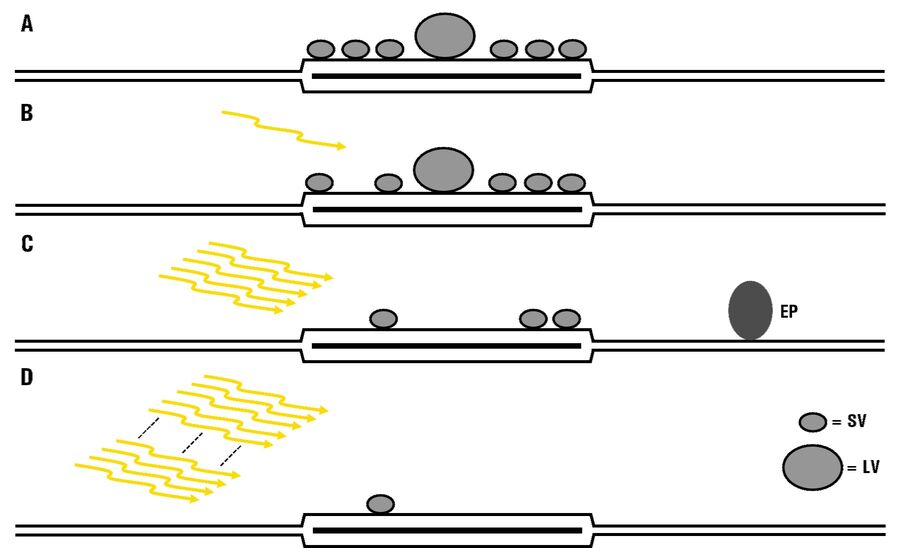
对接囊泡池的刺激依赖消耗
对轻度和强光刺激后的急性切片中的对接囊泡池进行分析得到了几个发现[1] 。利用单次脉冲诱发1个动作电位,对接囊泡数量略有减少,尽管不明显,这反映了苔藓纤维对CA3锥体神经元突触的释放概率低。然而,对接囊泡的平均直径显着增加,这表明较小的囊泡在单次刺激后更有可能首先被释放。经过5次脉冲的短暂刺激后,对接囊泡显着减少,证明囊泡释放,并且在切片和培养物中均观察到假定的内吞凹坑形成。最后,在强刺激(以前用作快速释放池耗尽刺激(100 pulses at 20 Hz))之后,对接囊泡池在急性脑切片和器官切片培养物中都基本耗尽[1]。图 3是研究结果的概述。
References
- C. Borges-Merjane, O. Kim, P. Jonas, Functional Electron Microscopy, ‘‘Flash and Freeze,’’ of Identified Cortical Synapses in Acute Brain Slices, Neuron (2020) vol. 105, iss. 6, pp. 992–1006, DOI: 10.1016/j.neuron.2019.12.022.
- D. Vandael, C. Borges-Merjane, X. Zhang, P. Jonas, Short-term plasticity at hippocampal mossy fiber synapses is induced by natural activity patterns and associated with vesicle pool engram formation, Neuron (2020) vol. 107, iss. 3, pp. 509-521, DOI: 10.1016/j.neuron.2020.05.013.