使用冷冻共聚焦显微镜定位核孔复合体
核孔复合体(NPC)是连接真核细胞核外膜和内膜的大的蛋白质组合体。NPC由几百个核孔蛋白(NUP)组合而成,这些核孔蛋白形成一个中心通道,使分子能够选择性地进行核质运输:RNA和核糖体蛋白质从细胞核运输,而在细胞质中翻译的核蛋白质、信号分子、脂质等则穿梭到细胞核中。
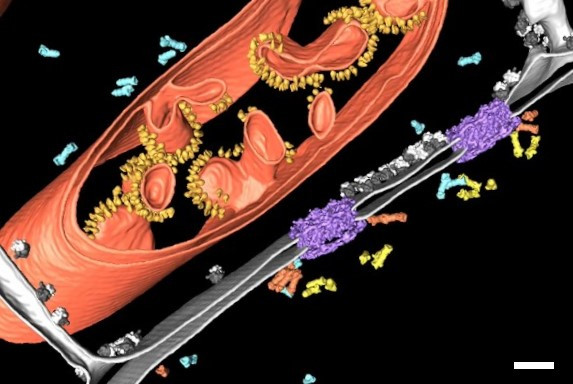
为了更好地理解NPC的结构-功能关系以及它们的生物发生和转换的调节,以最高的分辨率在细胞内部环境下研究它们的结构至关重要。图1显示了核膜冷冻电子断层照片的组分分割图[2]。断层照片显示,蛋白酶体与NPC结合,“在细胞核和细胞质之间的通道上建立了蛋白质降解枢纽”(Albert,S.等人,PNAS,2017年12月)。这清楚地显示了冷冻电子断层扫描(cryo ET)提供有关细胞结构和分子社会学的见解的方式。但是,如何用冷冻ET选择性地检查发生频率低的罕见特定细胞事件,例如经历自噬的NPC?
冷冻电子断层扫描
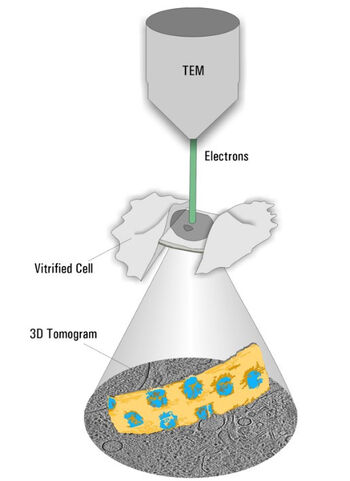
冷冻ET是一种专用的透射电子显微镜技术,该技术采集一系列倾斜图像,并重建观察区域的三维体积(图2)。随着EM硬件和软件的最新进展,可以实现亚纳米级的分辨率。为了使样品尽可能接近原生状态,应将其快速冷冻,以避免破坏性的冰晶形成。产生这种无定形冰的过程称为玻璃化。
冷冻FIB研磨
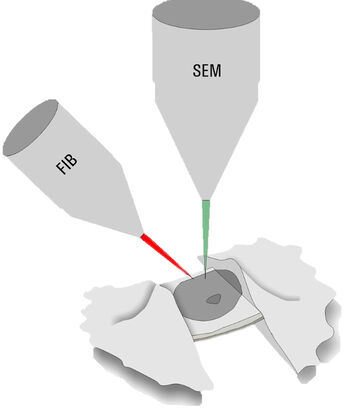
只有厚度低于300nm的标本才能通过冷冻电子断层扫描直接评估。较厚的样品,例如用于NPC分析的酵母细胞核,必须通过铣削过程进行打薄。专用双光束显微镜包括扫描电子显微镜和聚焦镓离子束(冷冻 FIB-SEM),用于烧蚀不需要的材料(图3)。
低温光学显微镜
为了获得特定细胞部位(如正在经历自噬的NPC)的断层照片,必须在FIB研磨和冷冻ET期间确定感兴趣的结构。由于在铣削之前或铣削过程中,大多数结构在SEM中无法清晰识别,因此需要一种在冷冻条件下可视化和定位感兴趣分子的方法。
为了解决该问题,冷冻荧光显微镜是必不可少的,例如使用THUNDER Imager EM cryo CLEM。使用基因编码的荧光标记,可以可视化细胞中的特定靶点,并识别和标记感兴趣的结构。接着,可以在后续的EM步骤中检索图像和xy坐标(图4)。
当然,显微镜硬件必须始终保持样品玻璃化。现代宽场显微镜系统使用非常灵敏的摄像头,甚至可以检测微弱表达的蛋白质。此外,通过应用最新的实时去除非焦面信号技术技术,可以解决宽场系统固有的难题,如离焦模糊。
然而,仅检索感兴趣结构的xy坐标是不够的,z坐标也是必要的,以尽可能地使-靶结构包含在产生的FIB薄片中。然而,在宽场显微镜中,沿光轴的分辨率是有限的。
为了提高z分辨率,照理说下一步该选择共聚焦。中间聚焦平面上的针孔会阻挡离焦光线,从而提高对比度和分辨率,尤其是沿z轴的对比度和分辨率(有关共焦原理的更多信息)。
使用共聚焦显微镜的三维定位工作流程
在下文中,描述了在3D冷冻共聚焦显微镜中识别荧光目标结构的工作流程,以及如何在冷冻FIB-SEM中检索荧光目标结构,目的是以更可靠的方式将其保留在最终FIB薄片中,以便在冷冻TEM中进行进一步研究。
同时,可以判断有关细胞及其相对于网格方格的位置的信息。在随后的EM步骤中,只能评估网格方格中心附近的目的细胞。为了改善细胞的定位,可以在将细胞接种到载网碳膜上之前应用微排布技术[3]。
在下文中,基于未发表的图像(德国海德堡EMBL的Herman Fung和Julia Mahamid提供)和《核孔的在细胞内的原位结构及其转换的快照》中的数据[1],详细解释了3D冷冻靶向过程。
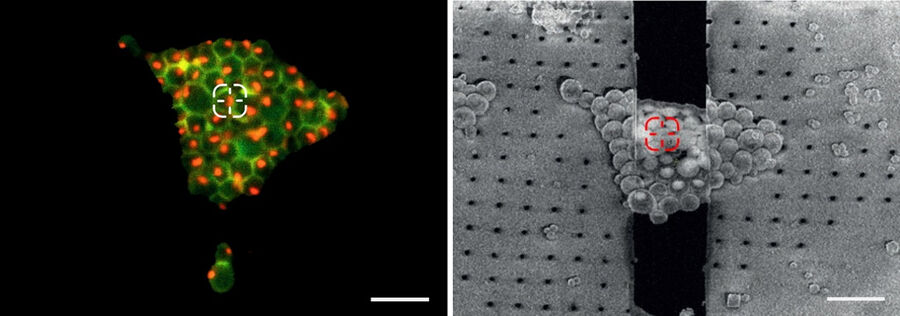
有关载网碳膜完整性的信息,以及荧光样品在网格方格内合适的位置,有助于选择合适的FIB研磨位置(图6)。
2.通过高分辨率共焦z堆叠获得3D信息
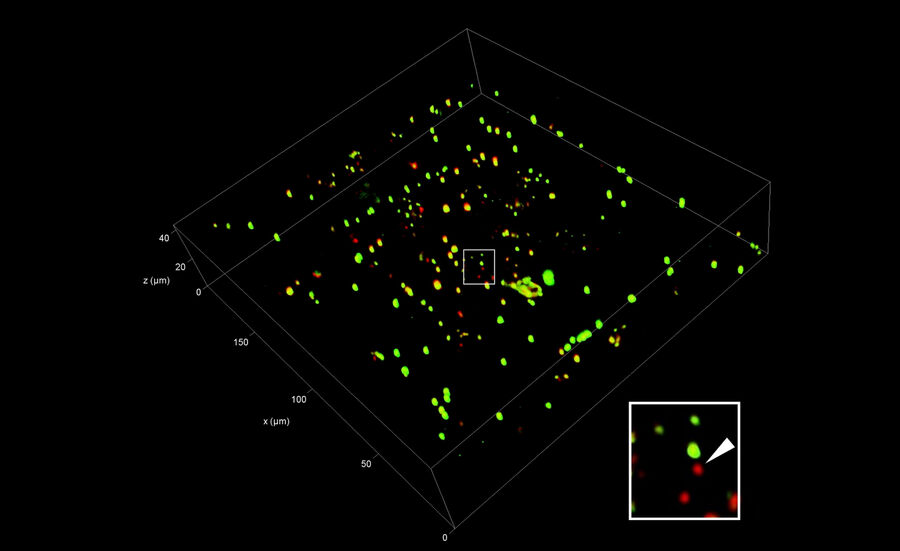
在为FIB铣削选择相关位置后,在这些位置沿光轴创建一系列荧光图像以获得3D信息。与普通宽场系统相比,要是想提高z方向的分辨率,共聚焦显微镜是首选方法。通过激光逐点扫描样品,只记录荧光发射的聚焦信息。然后,将在不同z位置记录的2D图像组合成3D堆栈(图7)。
显微镜系统的轴向分辨率主要取决于所用物镜的开启角度(所谓的数值孔径)。由于商品化冷冻显微镜为方便使用者而使用空气物镜(不需要浸入,可能会影响样品的玻璃化状态),因此实际分辨率有限。xy的典型分辨率为200 nm,z的分辨率约为800 nm。
为了能够正确定位感兴趣的细胞位置,可以将校准珠子作为参考结构应用于样品,以便在3D中对齐和关联荧光和EM图像[4]。
典型的珠子尺寸为1µm,完全呈球形,这使其中心坐标能够进行亚衍射拟合。通过SEM中的背散射电子,可以更清晰地观察到含有金属的微珠,从而将它们与大小相似的冰晶区分开来。优先选择荧光发射光不同于实际目标结构的荧光发射光的珠子,以便能够更好地区分(图8)。
3. 标记基准珠和靶
由于基准点在LM和SEM中都可见,因此它们的坐标可用于在两种模式之间转换旋转、平移和缩放等参数。然后,可以将共聚焦显微镜中标记的靶坐标转换为FIB铣削过程,以增加获得FIB薄片中具有感兴趣结构的概率。
然而,用于精确3D定位的商业软件解决方案尚未开发,但基于上述出版物(3D Correlation Toolbox),有一个开源解决方案可用。
使用3D Correlation Toolbox,可以加载共聚焦图像数据,标记靶和校准珠子,并自动确定其中心坐标。然后将定义的坐标标记投射到FIB图像上,以定义铣削的xyz坐标(图9)。
4. FIB研磨
为了将靶区域研磨成适当薄的体积,感兴趣结构的上方和下方各设定一个铣削窗口,如荧光信号投射到FIB图像上所示(图9)。然后施加镓离子束,并削除相应窗口中的材料。可以在一个EM网格上创建多个薄片,从而提高工作流的效率。
5. 冷冻电子断层扫描
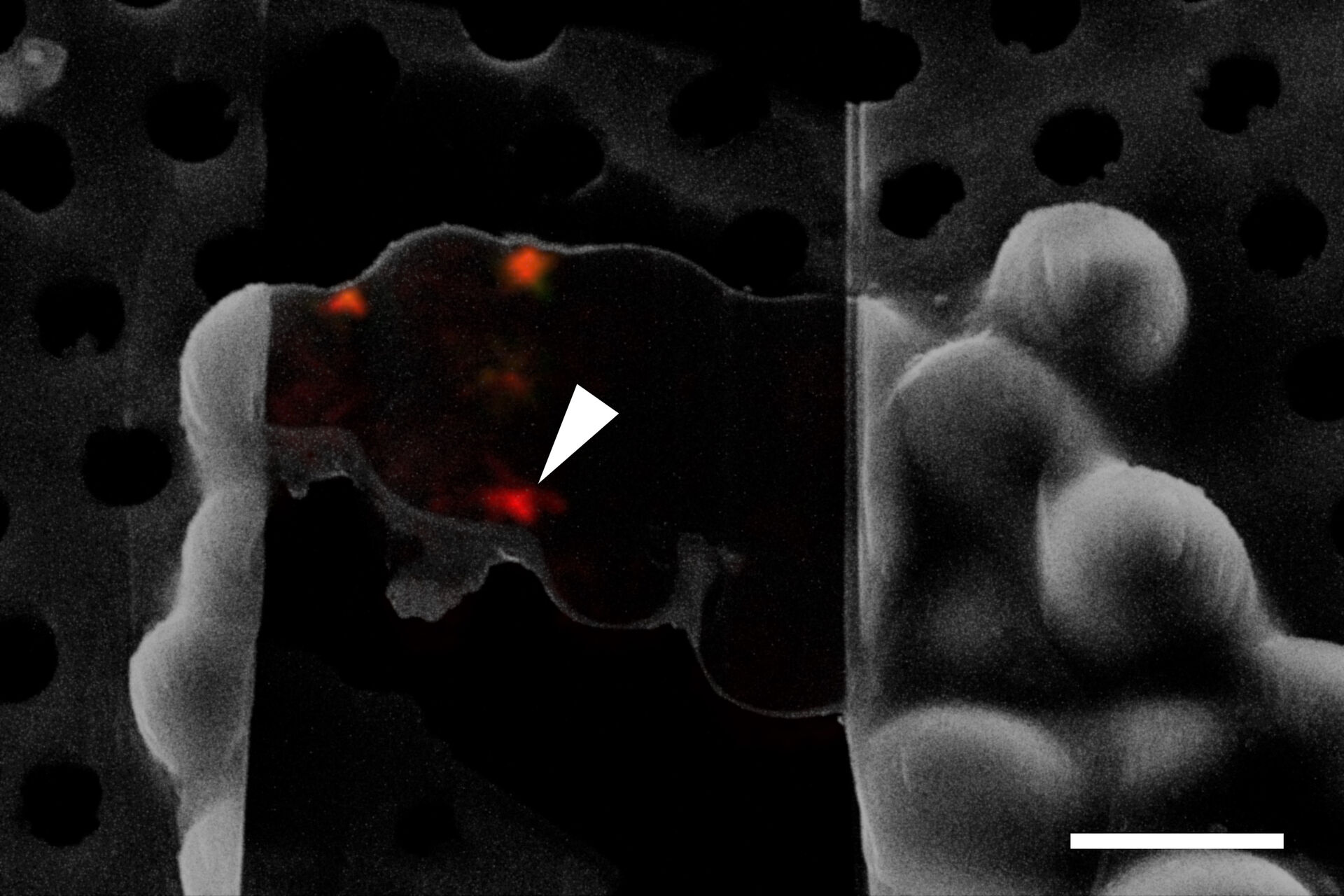
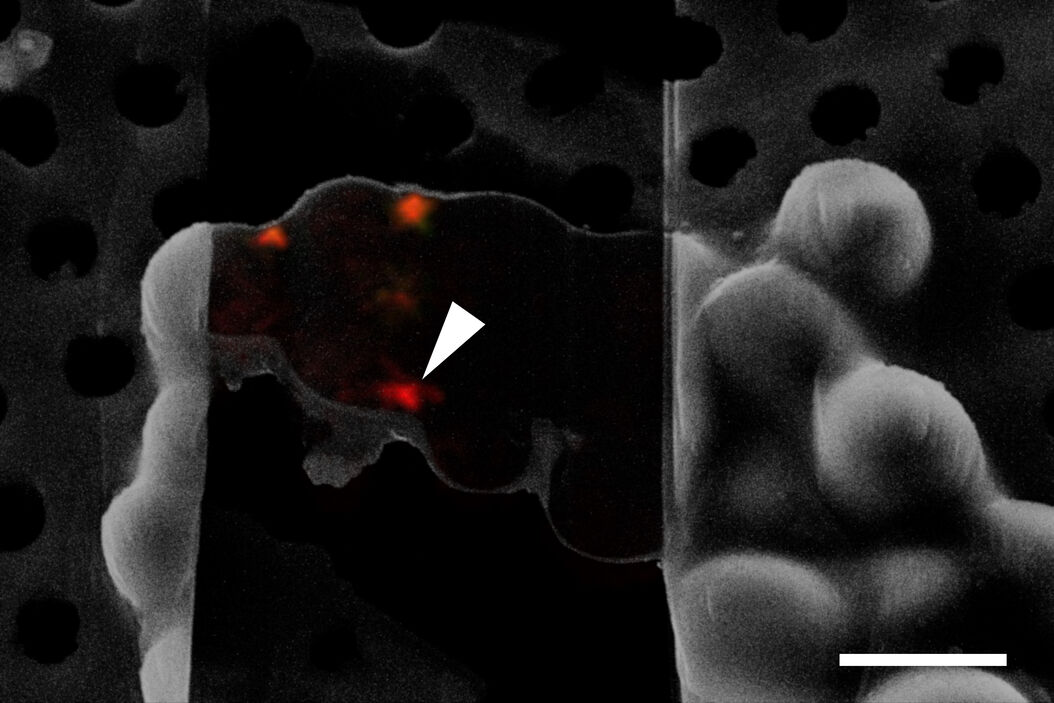
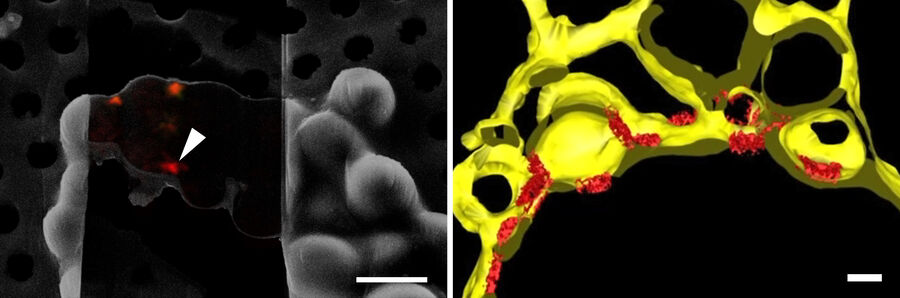
为了以分子分辨率获得样品的结构信息,使用冷冻透射电子显微镜对冷冻样品薄片进行成像。通过在薄片的SEM和TEM视图之间进行配准,可以根据薄片中包含的目标荧光信号确定倾斜序列采集区域。然后将成像的倾斜序列进行计算组合,以重建细胞内部的三维体积。通过对许多同类单个蛋白的结构信息进行平均(亚层析平均),可以获得更好的大分子解析结构。在图10中,图9所示的下薄片由冷冻ET成像。断层照片的分割结果显示了核膜与靶NUP位置。