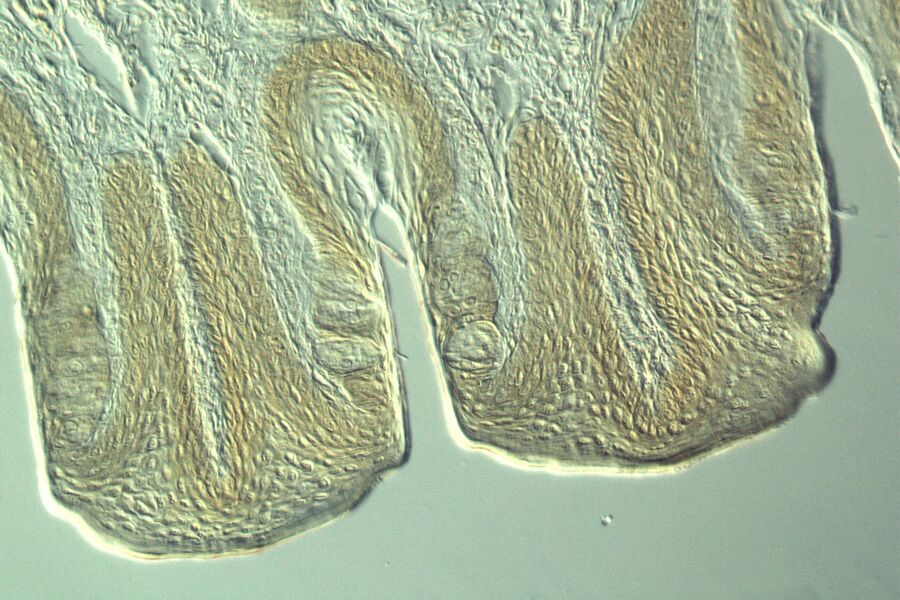
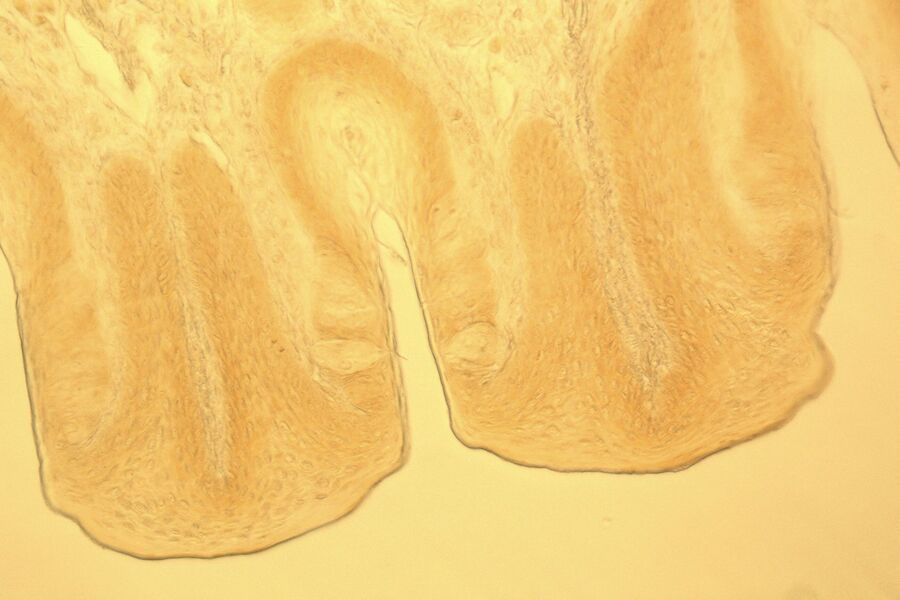
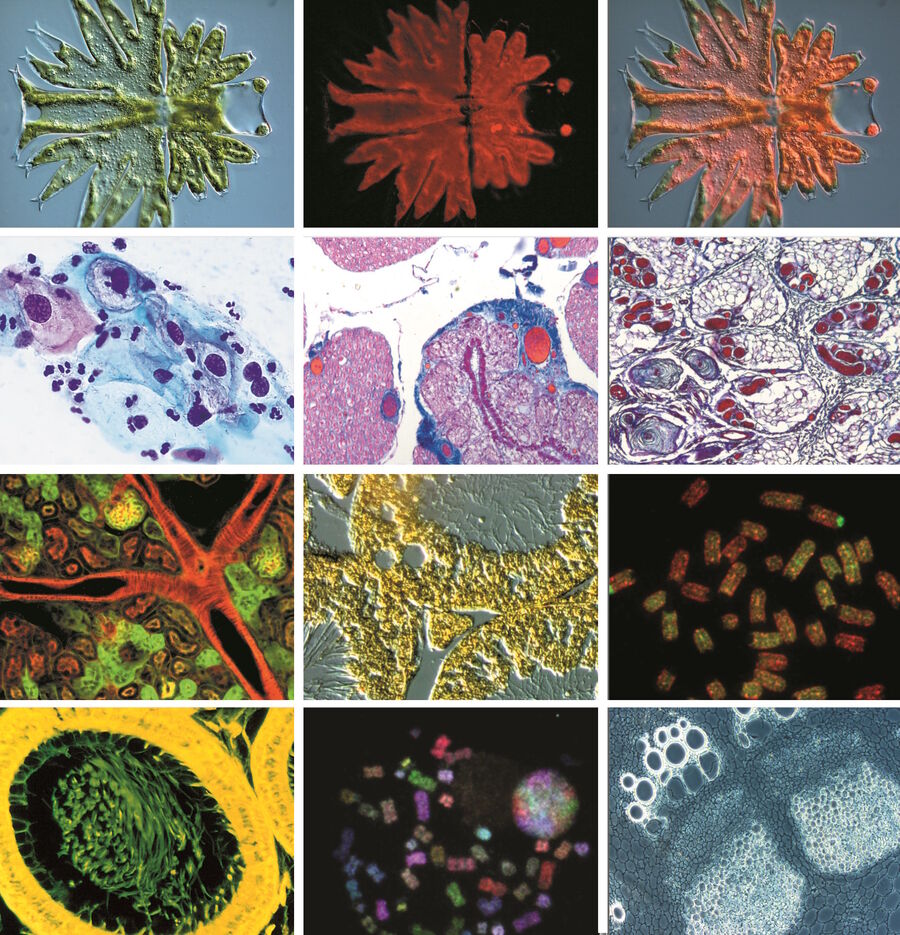
活体样本可视化的挑战
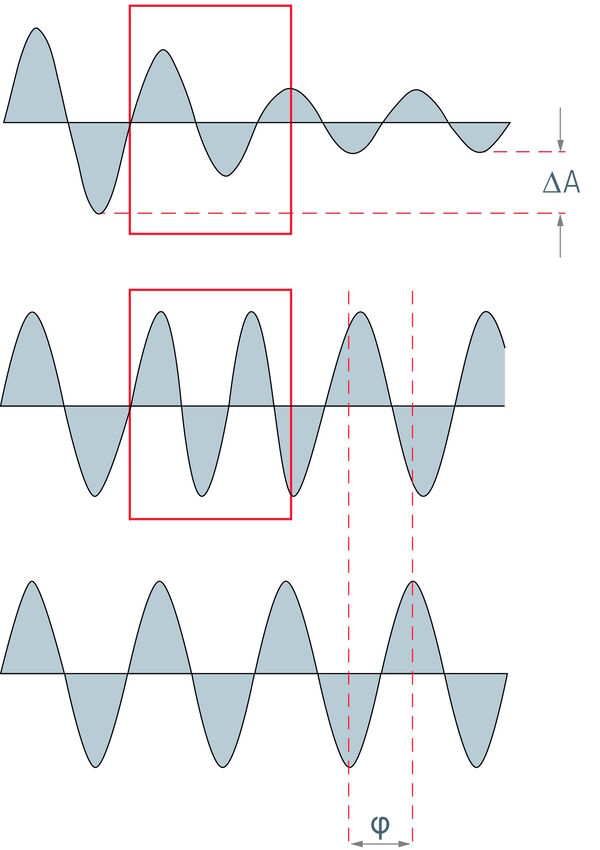
明视野显微镜通常只能提供未染色标本的微弱图像,其中只能检测到一些细节。要在图像中看到更多细节,增强对比度非常重要。增强对比度的一种方法是对样本进行染色。然而,这对生物体来说是不可能的,因此它们不会着色,看起来也不明显。实际上,这些样本也会与光学显微镜中的入射光发生相互作用。然而,所发生的相移是人眼无法察觉的。眼睛只能感受到振幅(亮度)和频率(颜色)的变化。
对比度是指区分样品和背景以及发现样品细节的可能性。对比度的定义是图像和相邻背景之间的光强与整体背景光强之间的差异。对于人眼来说,这些差异至少要达到百分之二才能被检测到。使用光电探测器可以大大提高对比度。
然而,对比度不仅取决于样本及其与光的相互作用本身。用于观察样本的光学系统及其记录图像信息的能力也至关重要。在 显微系统 中,对比度取决于正确的光圈设置、光学像差的等级、使用的对比度方法、标本和探测器。
因此,通过改变光阑的光圈设置,光学显微镜所获得图像的对比度可以不受对比度方法的影响。但是,如果聚光镜等缩小得太多,分辨率就会受到影响,并可能出现衍射伪影。
要获得足够的对比度,最古老的方法可能是先对样品进行染色。通常情况下,这只适用于死物,有时还需要一些复杂的染色方案。如果要观察活细胞,染色就不容易做到。因此,不同的技术(由适当的光学显微镜提供)旨在将光与样本相互作用产生的相移转变为幅移。
光与样本之间的相互作用
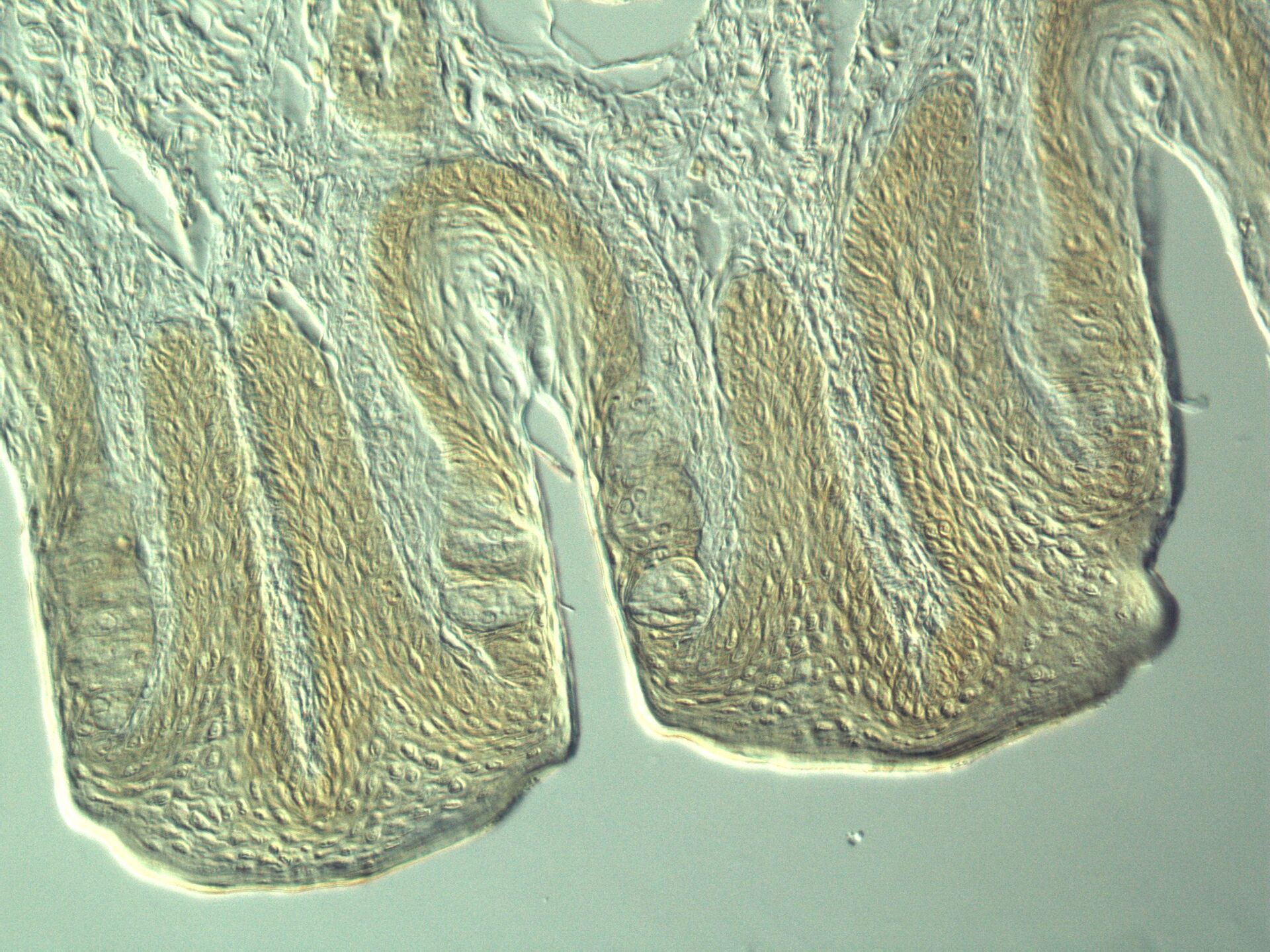
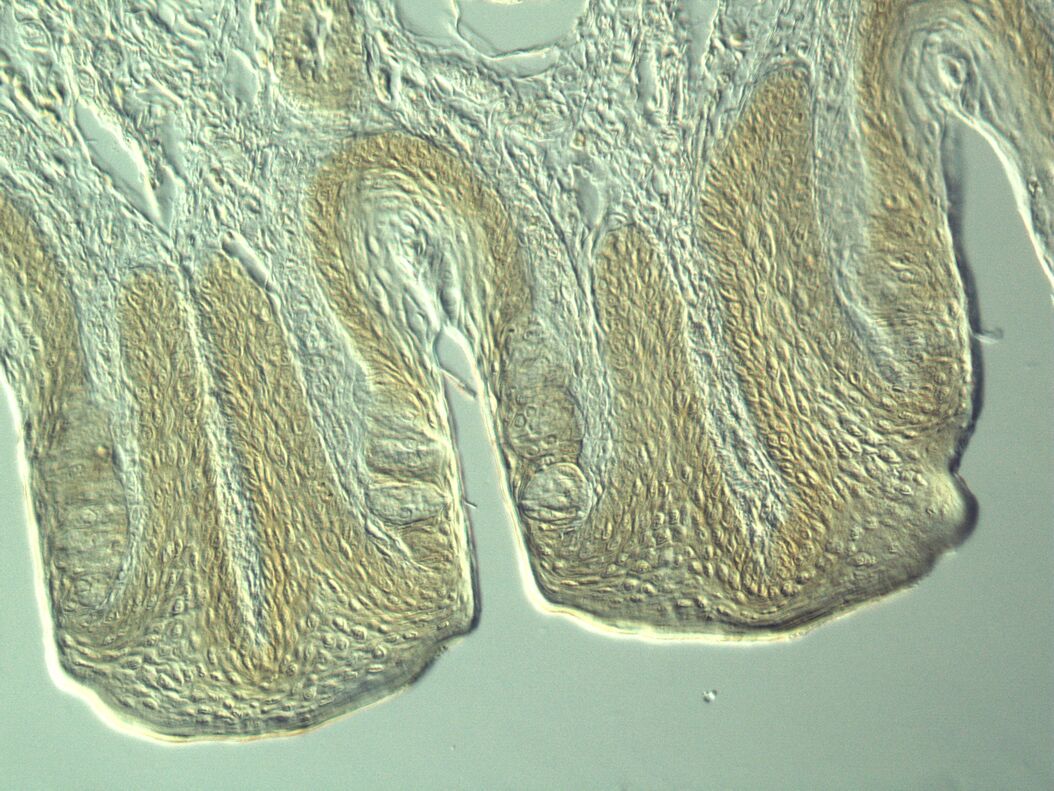
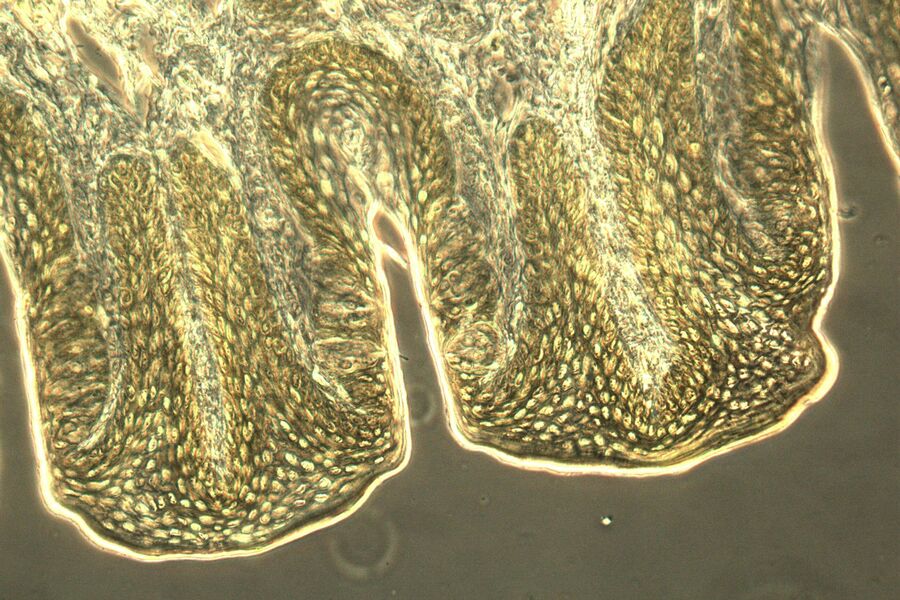
如果入射光照射到试样上,它们就会发生相互作用。吸收、反射、衍射、光散射和折射都是可能的结果。在此过程中,入射光波会发生变化。相位移动和振幅变化都是可能的。在这方面,我们可以区分相位物体和振幅物体。在理想情况下,相位对象是改变光波相位而非振幅的样本。相反,振幅对象只影响光的振幅而不影响光的相位。对于可见光而言,扁平和未染色细胞几乎达到了相位对象的特征。由于它们只是导致人眼无法看到的相位偏移,因此在明视野显微镜下的对比度非常低。振幅物体本身在明视野显微镜中的成像效果非常好。它们会降低振幅,从而降低通过光的强度。染色或自然着色的物体可以在明视野中很好地显示出来。它们属于振幅物体。它们会减弱通过的光线,从而减小波面的振幅。但它们并不是理想的振幅物体。除了振幅之外,它们还会影响入射光的成分。它们会吸收或反射特定频率的光波,而其他波长的光则可以不受阻碍地通过。由于试样和周围介质的折射率不同,会产生相移。如果光波进入细胞,它会准减速,而振幅保持不变。当光波离开细胞时,它会恢复速度,并以与之前相同的频率、波长和振幅穿过介质。然而,与只穿过介质的光相比,它的相位发生了偏移。由于人眼和其他光学检测器无法识别和检测光波的相位变化,因此在未染色和未着色的标本中,对比方法的主要目的是产生振幅对比,并将相位对比转变为振幅对比。
对生物研究产生巨大影响
与使用固定和染色的物体相比,使用未染色标本具有许多优势。它允许在生物显微镜下观察活体,没有固定和染色的人工痕迹。例如,固定和染色会使标本收缩或膨胀。此外,还有可能破坏细胞中的独特结构或严重改变其形态。消除这种危险的唯一可靠方法就是使用活体样本,因为活体样本没有伪影,能提供可靠、真实的信息。
活细胞显微镜的另一大优势是可以检查随时间变化的情况。除了获得细胞的静态信息和情况快照外,还可以随时监测整个过程,如细胞运动、细胞分裂和细胞凋亡。由于这些过程有时会耗费大量时间,因此最好在光学显微镜系统中添加一个摄像头,以记录延时影片。
不同的光学对比方法所获得的信息和印象因其来源而异。因此,建议结合使用不同的对比技术,以获得最准确、最详细的受检样本图像。明视野通常无法准确观察细胞的形态,而其他光学对比方法则可以提供更多信息。
在 活 细胞图像 中添加 荧光 标记可获得更多信息。可以用 GFP 等荧光蛋白标记细胞中感兴趣的蛋白质。然后就可以通过光镜图像追踪并准确确定其在细胞内的定位。此外,还可以将 GFP 与多肽定位信号结合起来。通过这种方法,像内质网这样的独特区块就可以被可视化。
研究中使用的现代光学显微镜通常采用模块化设计,可以在各种对比方法之间快速切换,甚至可以同时使用。光学对比方法为在实验室日常工作中轻松检查活体和无色标本提供了可能。