为什么要使用细胞培养插板?
细胞培养插板,也称为细胞培养支撑物,用于更好地模拟体内细胞所处的三维环境[1,2]。与培养皿、烧瓶或多孔板的平面表面不同,细胞培养插板中的顶(上)面和基侧(底面)细胞表面都暴露于培养环境中。这些插板被放入多孔板中,市面上有各种类型的膜、涂层、定制表面以及孔径和密度可供选择。细胞培养插板还用于研究细胞转运、分泌、扩散、迁移和组织工程。
在这里,目标是使用细胞培养插板,利用人类诱导多能干细胞(iPSCs)生成类似脑毛细血管内皮细胞[3,4]。这些类似脑细胞的内皮细胞与星形胶质细胞、周细胞和神经元一起构成血脑屏障(BBB)。构建高质量和准确的血脑屏障体外评估系统对于筛选治疗神经退行性疾病和与血脑屏障相关的疾病的药物具有重要意义。
在细胞培养插板中检查细胞的传统方法
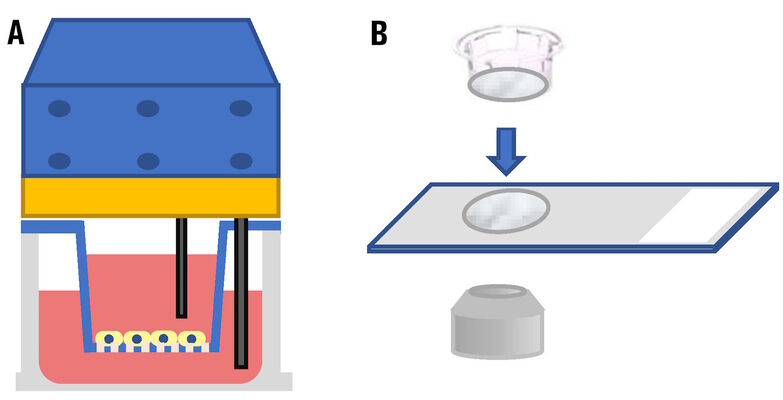
直到最近,如果用户需要在实验过程中评估设置在多孔板中的细胞培养插板中的细胞,基本上有两种方法。他们可以使用专用电极来检查培养细胞的电阻,或者移除覆盖插板的膜,取出插板,然后使用显微镜在玻片上观察(请参考图1)。
THUNDER成像仪利用了高性能的物镜,可以实现高分辨率并具有长工作距离。Leica物镜的放大倍数为16倍,数值孔径(NA)为0.6,工作距离为2.5毫米(请参考图3),可以与THUNDER成像仪一起使用,以观察仍设置在多孔板中的细胞培养插板中的活细胞。
使用插板的活细胞THUNDER成像
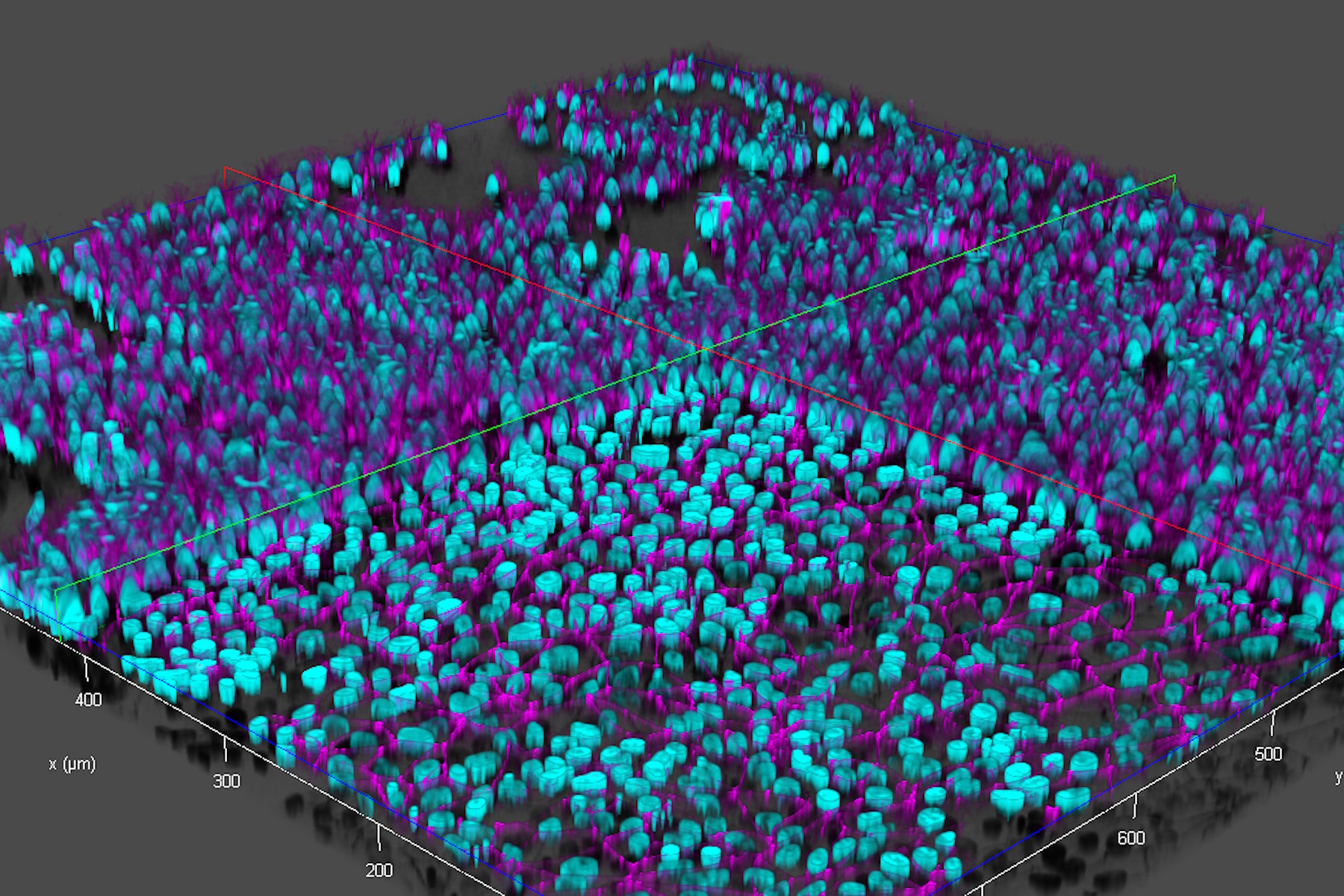
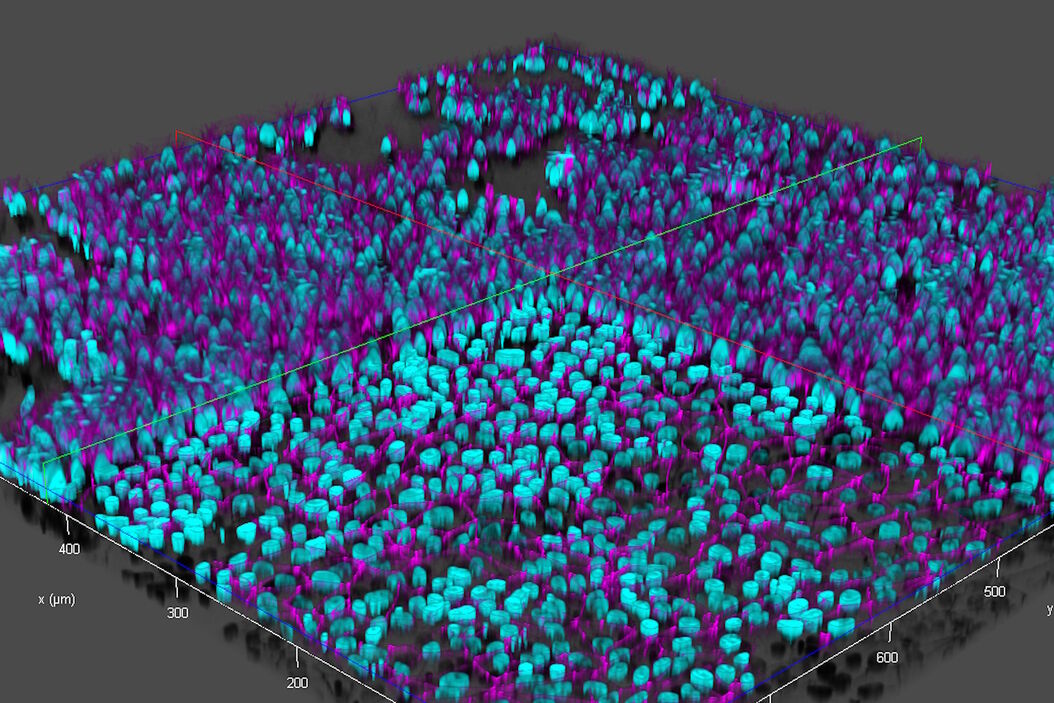
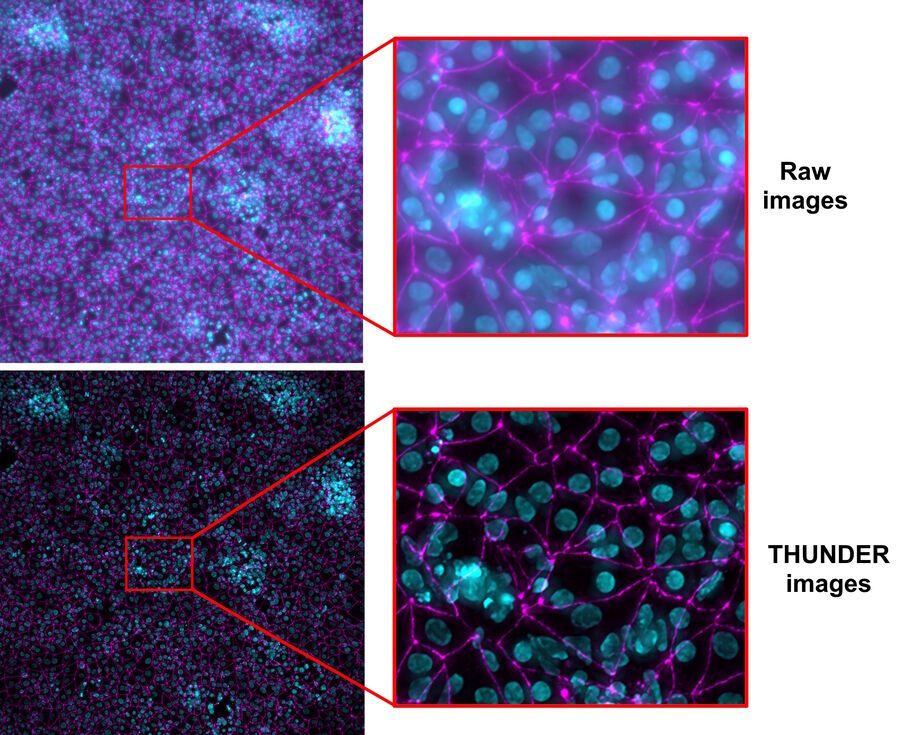
本研究使用了从人类诱导多能干细胞(iPSCs)中获得的类似脑毛细血管内皮细胞。将iPSC衍生的内皮样细胞用DAPI染色以标记细胞核(青色)并用Alexa Fluor 488染色以标记紧密连接(品红色) [5],然后培养在设置在12孔板中的插板中(来自Corning的插板和孔板) [3,4]。有关细胞培养和制备的更多详细信息,读者可以参考参考文献3和4。
使用THUNDER成像仪获取设置在多孔板中的细胞培养插板中活内皮样细胞的超高速和高分辨率图像:
- 快速Z轴成像,在大约20秒内获取垂直(Z)方向上的70个焦平面,同时使用快速通道切换在两个波长之间交替(参考图4);
- 通过计算清除法(Computational Clearing)[6,7]去除活细胞样本原始图像中的散射光(参考图5)。
与使用传统的宽场显微镜相比,当使用THUNDER Imager Live Cell或3D Assay时,细胞培养插板中生长的iPSC的检查速度大约提高了3倍,因为无需将插板从多孔板中取出进行显微镜成像。