引言
医药产品中的微粒污染,例如药物(液体和固体药片)、静脉注射(IV)/输液溶液、滴眼液和吸入器 [1-7],里存在的微粒污染,可能会对重症患者造成重大威胁。为了保证医药产品的质量和安全,识别和消除药品中的微粒污染至关重要。然而,如果只对微粒进行目视检查,可能难以找到污染源。对微粒进行化学分析更容易找到污染源,但最常用的扫描电子显微镜和能量色散光谱(SEM/EDS)方法不仅流程复杂、耗时长,且无法揭示微粒颜色信息 [3,7]。光学显微镜和激光诱导击穿光谱(LIBS)相结合的二合一材料分析方法,可以确定微粒的形状、大小、颜色和组成,快速、可靠且经济实惠[8]。它可以同时对微粒污染物进行目视检查和化学分析,而不需要额外进行样品制备或使用多台仪器。目前用于研发和工程实验室等非监管环境的DM6 M LIBS 二合一材料分析系统在制药工业污染根本原因分析方面表现出巨大潜力 [9]。
制药工业中的微粒污染
医药产品中的微粒污染,如药品(液体和固体药片/片剂),静脉注射(IV)/输液溶液、滴眼液和吸入器等的微粒污染,来源广泛(包括溶液、包装、密封件中的未溶解残留物等)[1-4]。微粒污染物的组成多种多样,包括金属、玻璃和合成(橡胶)材料等[1,3,4]。微粒污染可能会对患者造成威胁,因为它们可能会导致败血症、全身炎症反应综合征(SIRS)、器官功能障碍或衰竭、静脉炎和肉芽肿性肺动脉炎 [4-6]。
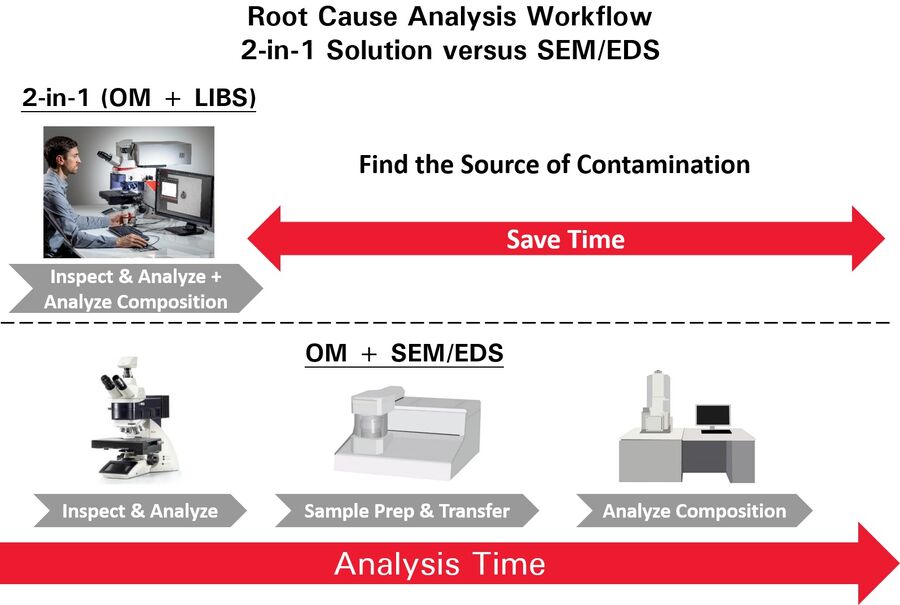
微粒污染识别可以分为几个步骤。第一步是用光学显微镜进行目视检查,以确定微粒的大小、形状、显微结构和颜色,并对它们进行计数。下一步是对微粒进行化学分析,以确定成分,更容易找到微粒来源(根本原因分析)。微粒化学分析通常使用SEM/EDS进行,然而,SEM/EDS需要将样品转移到真空室将污染微粒分离出来,成本高昂、耗时长。二合一方法对微粒的目视检查和化学分析更有效(见图1)。
微粒分析
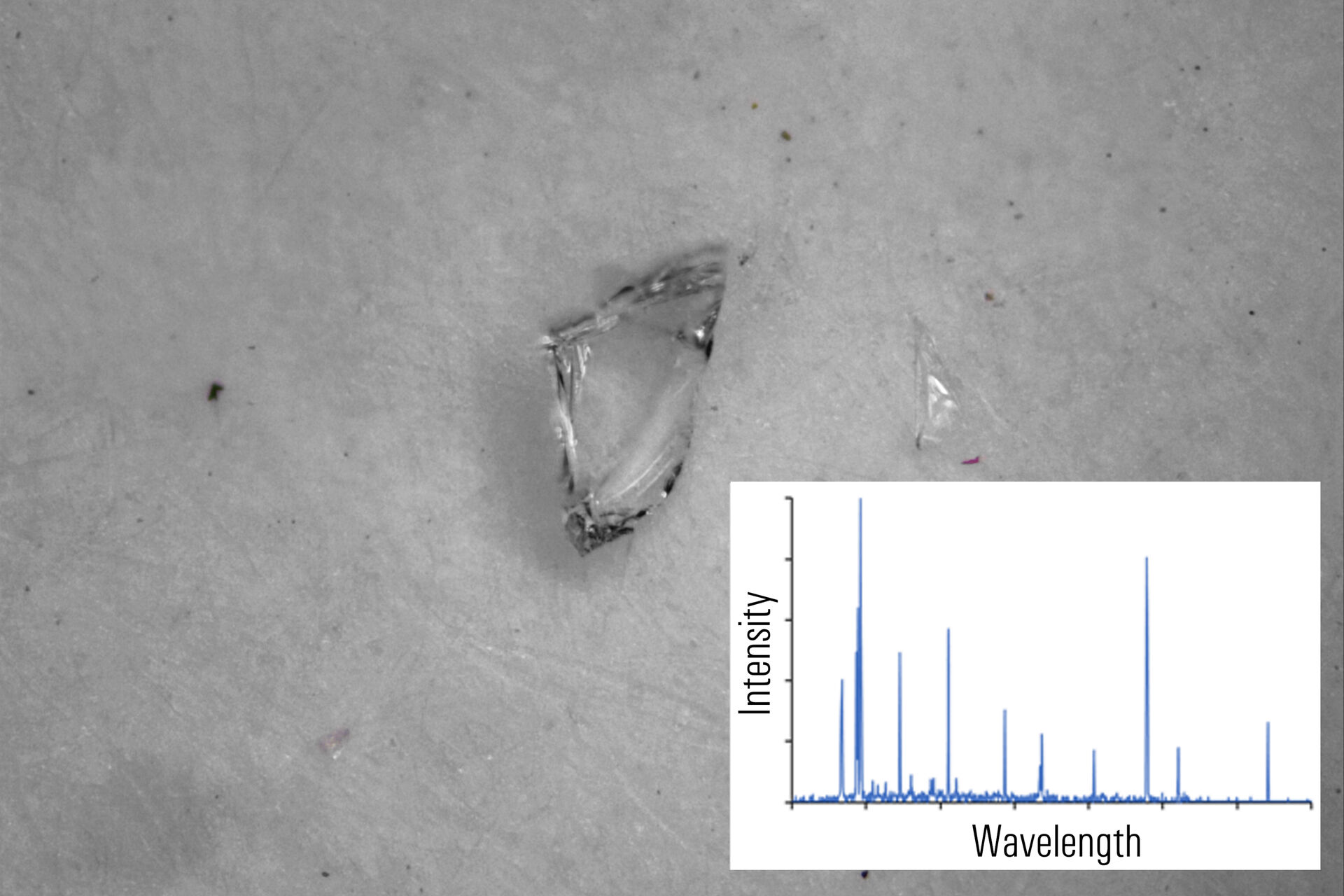
仅进行目视检查时,不同金属微粒(高合金或低合金钢、铝合金等)的外观非常相似,有时很难确定微粒污染源。在这种情况下,对微粒进行瞬时成分分析将极有助于有效找到微粒来源,从而有效减少药品中的污染物。然而,如上所述,使用SEM/EDS进行成分分析,过程缓慢、繁琐。
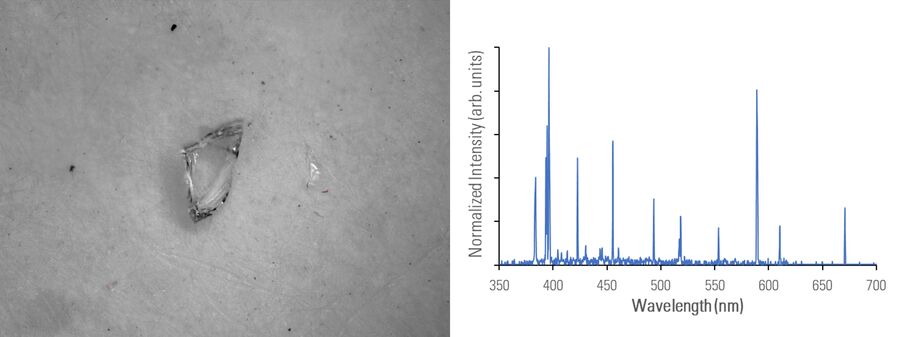
使用二合一解决方案,如徕卡显微系统的 DM6 M LIBS,比SEM/EDS更具优势(图1)。例如,使用LIBS元素分析可以看到微粒的真实颜色,从而快速有效地确定污染源。当仅凭目视检查还不够时,用户可以根据LIBS光谱中的光谱指纹和特征信号来识别微粒。因此,LIBS可以提供与药品微粒污染相关的有用元素信息。
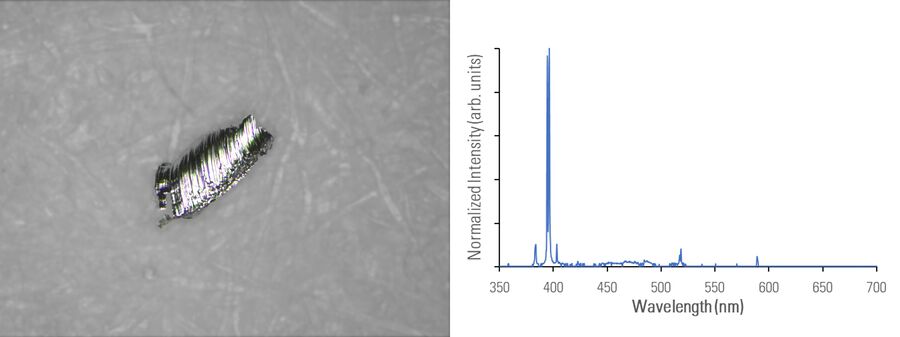
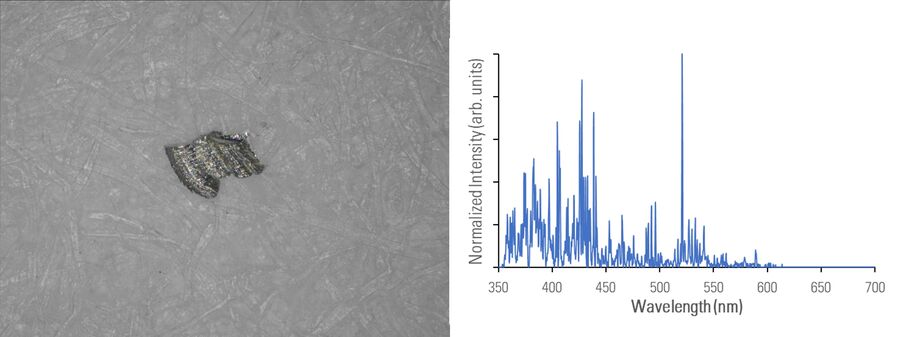
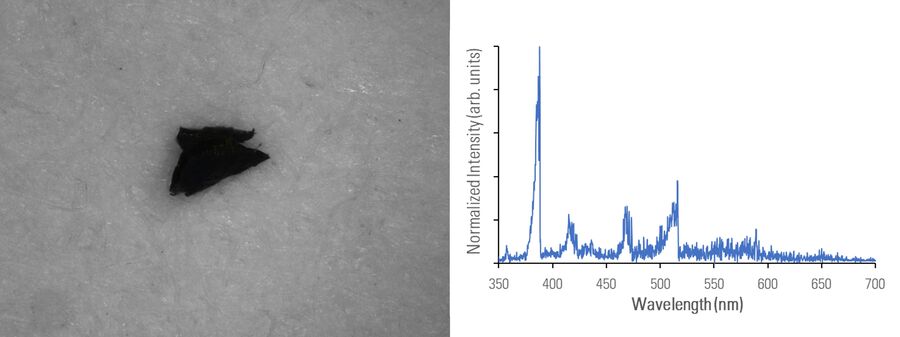
在下图2A-E中,用光学显微镜对不同材料组成的微粒进行成像,并使用 DM6 M LIBS 二合一方法用LIBS进行分析。
不同的金属微粒(钢和铝合金)可能具有相似外表,因此使用二合一方法进行快速成分分析,将极有助于更有效地寻找微粒来源,以进行制药工业的根本原因分析。即使在外观上存在差异,如颜色(参见图2D中黑色橡胶微粒或图2E中金色/黄色黄铜微粒),也可以通过LIBS验证所假设的微粒组成。
总结与结论
使用高分辨率光学显微镜和激光诱导击穿光谱(LIBS)相结合的二合一方法,例如DM6 M LIBS, 可以同时对污染微粒进行目视检查和化学分析。对于非管制环境,二合一方法是一种更实用的有效识别和消除污染源的解决方案。二合一方法不需要额外进行样品制备或使用多台仪器,大大节省了时间。二合一方法可以更快、更简便地进行根本原因分析,从而更有效地减少患者使用药品的风险。
参考文献
- G.L. Shearer, Contaminant Identification in Pharmaceutical Products, The Microscope (2003) vol. 51, iss. 1, pp. 3-10.
- A. Scatena, Foreign particulate analysis can identify contaminants hiding in your product materials that impact performance, quality, and safety, Materials Analysis, Gateway Analytical.
- Jordi Labs, Residue and Particulates Identification in Pharmaceutical Products, AZO Materials (10 Nov 2017) Article 14756.
- T. Standl, Particles In Parenteral Injection Solutions: A Report About The PDA Convention Europe, 2017, Kompakt Anästhesiologie und Intensivmedizin (2018).
- J.W. Puntis, K.M. Wilkins, P.A. Ball, D.I. Rushton, I.W. Booth, Hazards of parenteral treatment: do particles count?, Archives of Disease in Childhood (1992) vol. 67, iss. 12, pp. 1475-1477.
- M. Perez, B. Décaudin, A. Maiguy-Foinard, C. Barthélémy, G. Lebuffe, L. Storme, P. Odou, Dynamic Image Analysis To Evaluate Subvisible Particles During Continuous Drug Infusion In a Neonatal Intensive Care Unit, Scientific Reports (2017) vol. 7, art. num. 9404, DOI: 10.1038/s41598-017-10073-y.
- T. Jack, B.E. Brent, M. Boehne, M. Müller, K. Sewald, A. Braun, A. Wessel, M. Sasse, Analysis of particulate contaminations of infusion solutions in a pediatric intensive care unit, Intensive Care Medicine (2010) vol. 36, pp. 707–711, DOI: 10.1007/s00134-010-1775-y.
- J. DeRose, K. Scheffler, Cleanliness Analysis with a 2-methods-in-1 solution: See the particles and know their composition at the same time, Science Lab (2019) Leica Microsystems.
- S. Nisar, G. Dastgeer, M. Shafiq, M. Usman, Qualitative and semi-quantitative analysis of health-care pharmaceutical products using laser-induced breakdown spectroscopy, Journal of Pharmaceutical Analysis (2019) vol. 9, iss. 1, pp. 20-24, DOI: 10.1016/j.jpha.2018.10.003.
相关文章
-
![[Translate to chinese:] Particulate contamination in between moving metal plates. [Translate to chinese:] Particulate contamination in between moving metal plates.](/fileadmin/_processed_/b/d/csm_Particulate_contamination_in_between_moving_metal_plates_2_61b4c1c546.jpg)
高效清洁度分析的关键因素
在汽车和电子行业,零部件上细小的污染颗粒物也可能影响产品的性能,导致产品出现故障,或使用寿命缩短。对于汽车来说,过滤系统很容易受到影响。对于电子产品来说,印刷电路板(PCB)或连接器上的污染可能会导致…
Jan 03, 2024Read article


![[Translate to chinese:] Image of an integrated-circuit (IC) chip cross section acquired at higher magnification showing a region of interest. [Translate to chinese:] Image of an integrated-circuit (IC) chip cross section acquired at higher magnification showing a region of interest.](/fileadmin/_processed_/a/c/csm_IC_chip_cross_section_b2bf8f2497.jpg)
![[Translate to chinese:] Optical microscope image of salt contamination on an aluminum/silicon (Al/Si) surface. Credit: Gerweck GmbH, Germany. [Translate to chinese:] Optical microscope image of salt contamination on an aluminum/silicon (Al/Si) surface. Credit: Gerweck GmbH, Germany.](/fileadmin/_processed_/0/5/csm_Electroplating_LIBS_on-dema_96d3461bc7.jpg)
