历史背景
从18世纪路易吉·伽伐尼(Luigi Galvani)的开创性工作开始,到19世纪埃米尔·杜布瓦-雷蒙德(Emil du Bois-Reymond)、约翰内斯·彼得·穆勒(Johannes Peter Müller)和赫尔曼·冯·亥姆霍兹(Hermann von Helmholtz)的工作,质膜和细胞的兴奋性一直是神经系统研究的主要兴趣[1]。艾伦·劳埃德·霍奇金(Alan Lloyd Hodgkin)和安德鲁·赫胥黎(Andrew Huxley)在1952年使用电压钳技术揭示了动作电位的离子通道事件,并于1963年因其杰出的工作而获得诺贝尔生理学和医学奖[2,3]。
那时,电压钳仅能用于相当大的细胞,因为需要锋利的微电极来穿透质膜。在1970年代末,贝尔特·萨克曼(Bert Sakmann)和埃尔文·内尔(Erwin Neher)改进了电压钳技术,并且首次解析了青蛙骨骼肌膜片上的单离子通道电流。他们因此荣膺1991年诺贝尔生理学和医学奖[4,5]。下一个突破则是贝尔特·萨克曼(Bert Sakmann)在1980年发明的高阻封接,极大地提高了信噪比,并允许记录更小的电流[6]。
电生理学,最初诞生在特殊的生物物理实验室,现在已经扩展到基础生物学和医学研究领域,并成为研究神经系统中单个细胞或整个细胞网络行为的最重要工具之一。
膜片钳技术的一般原理
膜片钳技术可以研究若干,甚至单个离子通道[7]。因此,它引起了兴奋类细胞研究工作的极大兴趣,例如神经元、心肌细胞和肌纤维。[8]。
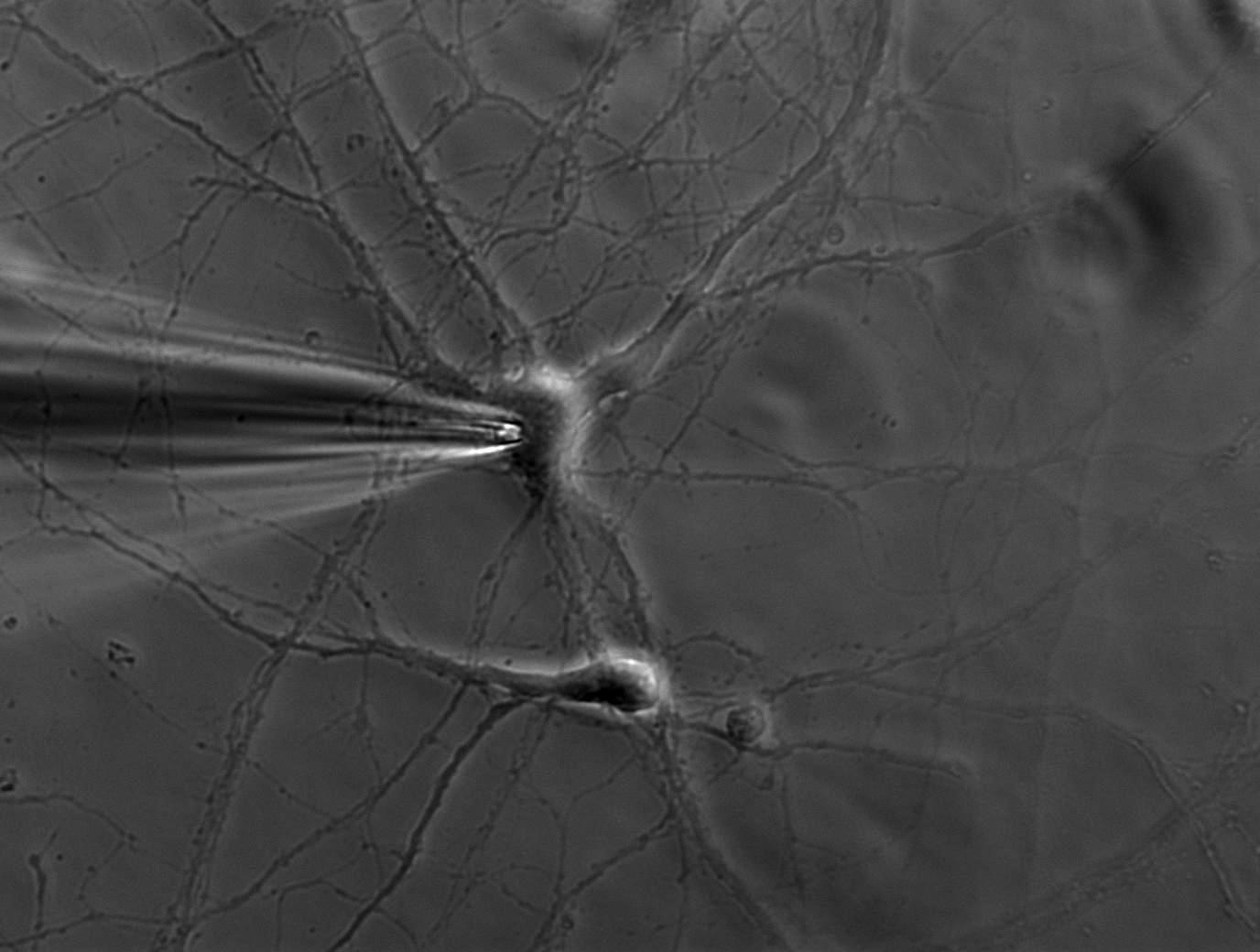
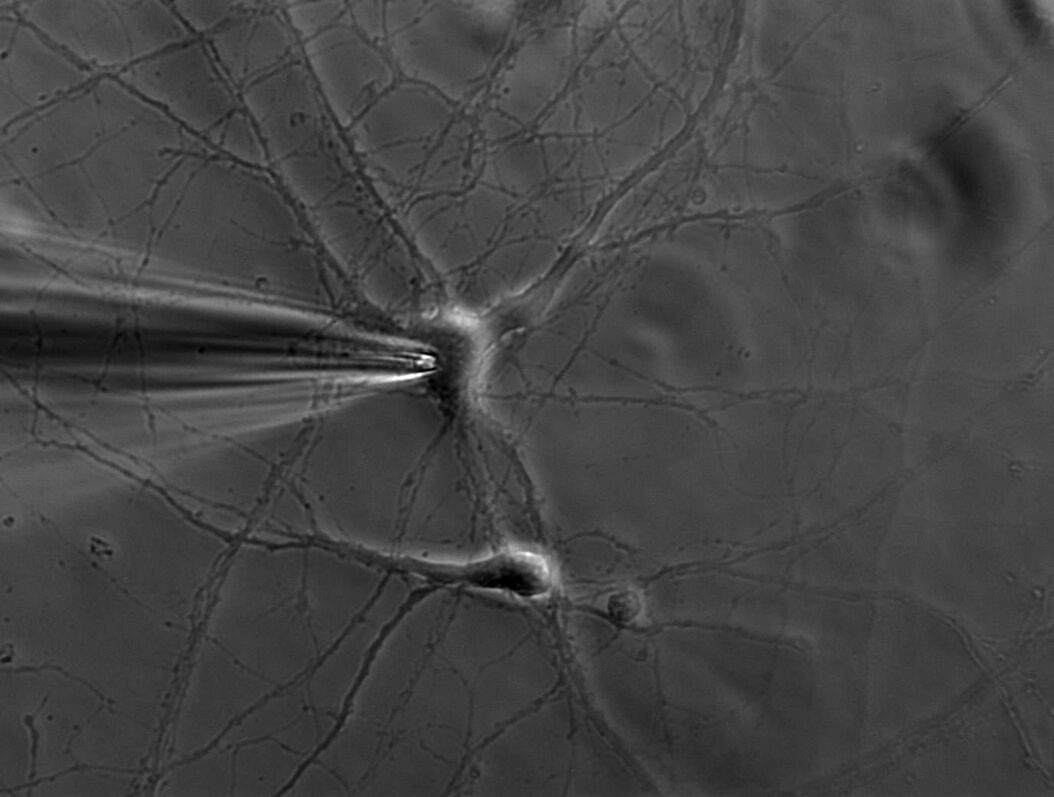
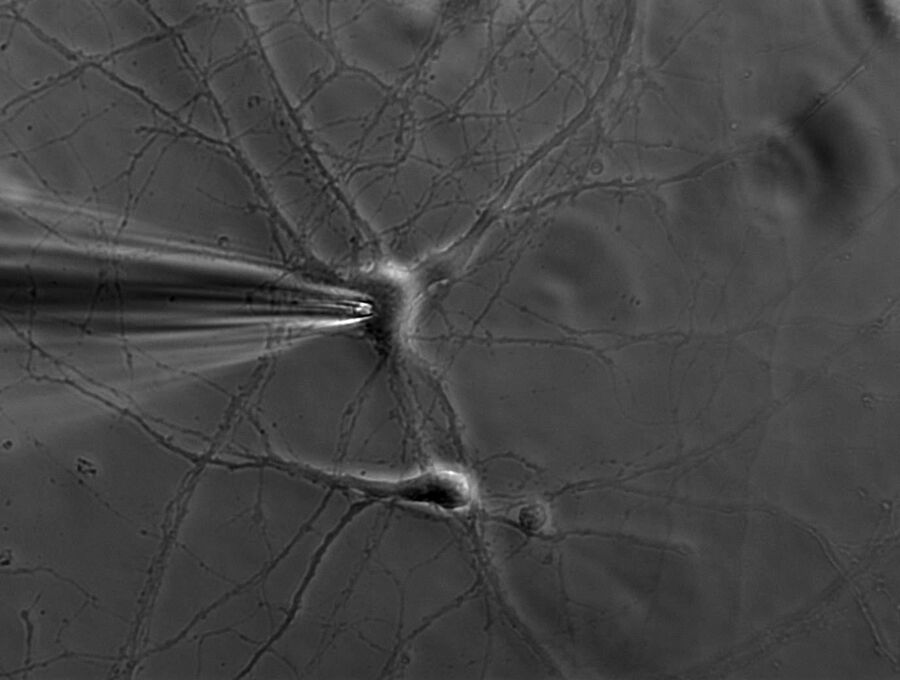
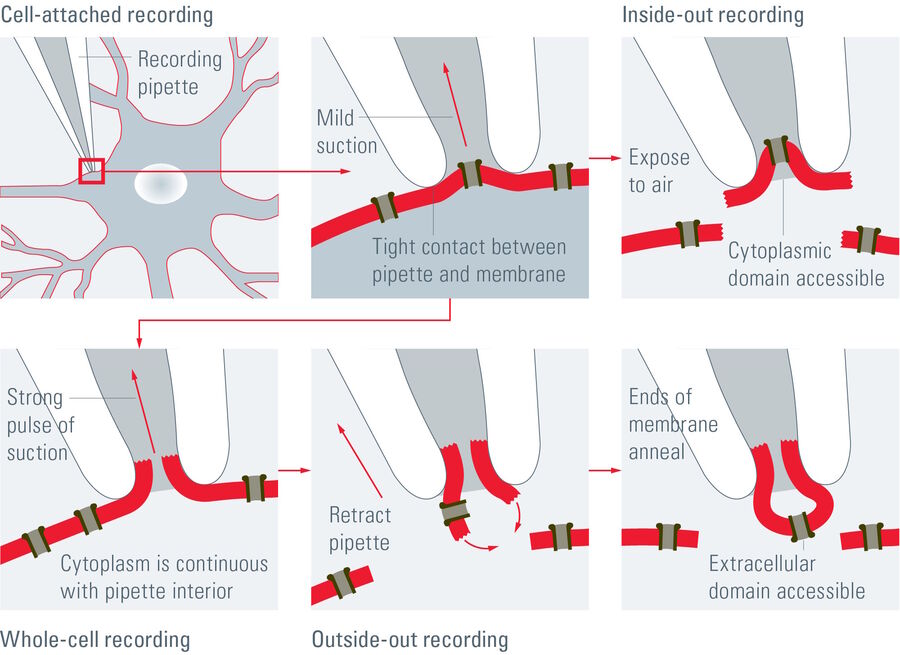
单个离子通道每秒可以传导约1000万个离子。不过,电流仅有几皮安。记录这种数量级的电流不仅对研究人员,对于设备而言同样极具挑战。原理是将带有钝端的薄玻璃或石英管密封在膜上(参见图1、2和3)。
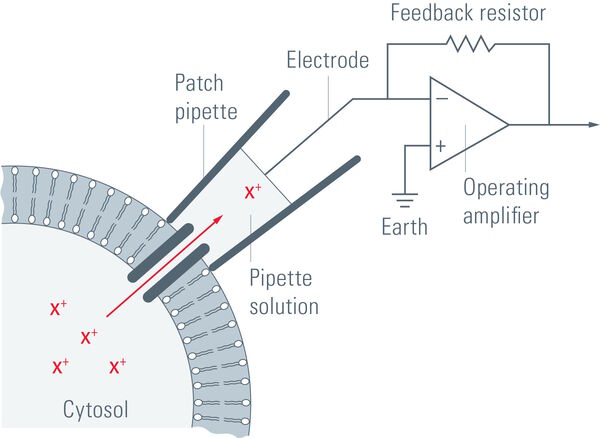
施加吸力可以产生千兆欧姆级别的高阻抗封接。这种紧密封接可以对膜片进行电隔离,这意味着流过膜片的所有离子都会流入微电极,并借助连接到高灵敏度电子放大器的氯化银线电极((Ag/AgCl)电极)记录。浴电极用于设置零电平。
为了防止细胞膜电位发生变化,放大器会产生类似于流经细胞膜电流的补偿电流,作为负反馈机制(参见图1)。
测量细胞的膜电位并将其与指令电位进行比较。如果指令电位和测量值之间存在差异,则会注入电流。该补偿电流将记录下来,并可以得出有关膜电导的结论。膜电位可以独立于离子电流进行操纵,这种能力可以研究膜通道的电流-电压关系。
膜片钳配置
根据研究对象,可以使用不同的配置。在细胞贴附模式下,膜片保持完整(参见图3)。松散贴片是细胞贴附模式的修改版。这种情况下,移液器没有紧密封接在细胞膜上,而是松散地贴附在细胞膜上。该模式通常用于记录神经元细胞中的动作电位。它的优点在于细胞质的成分不受影响。不过,另一方面,细胞内环境无法控制。
通过电极微管施加造孔剂(通常为抗生素)会产生穿孔膜片来保证离子连续性,同时细胞内蛋白质不会被电极液洗掉。最常用的膜片钳模式是全细胞模式(参见图3)。要实现这种模式,通过短暂施加强吸力来破坏膜片。微电极内部与细胞质连为一体。该方法用于记录来自整个细胞的电位和电流。对于全细胞测量方式,研究人员有两种配置方式可供选择:电压钳模式,其中电压保持恒定并记录电流,或者电流钳模式,其中电流保持恒定并观察膜电位的变化。
此外,也可以仅记录来自小块而不是整个细胞的电流。这增加记录单个离子通道的机会。膜片可以根据微电极内部的两个不同方向确定方位。为实现内面向外的配置,微电极贴附在细胞膜上,并且可以收回以撕下一小片膜(图3)。本例中,细胞膜的胞质表面暴露在外面。这种方法通常用于研究单个通道的活性,优点在于可以调整暴露在细胞内表面的培养基。
如果希望研究细胞外诱因(如神经递质)的影响,则应选择外面向外的配置(参见图3)。这种情况下,移液器在全细胞测量配置中收回,导致细胞膜破裂并重组。在该配置中,细胞外表面暴露,因此可以轻松应用细胞外诱因。
要求
膜片钳实验适用于培养细胞、急性解离细胞或者急性振动切片,从而研究细胞在其自然环境中的电生理学特性。感兴趣的离子通道也可以在通用细胞系(HEK293、CHO、LNCaP)中分离并异质表达。
根据样品不同,需要使用倒置(培养细胞)或者具有稳定平台的正置固定载物台显微镜(切片样品)。如果要研究急性切片中的细胞,建议使用红外DIC(微分干涉对比)显微镜[9],后者可以更加方便地观察细胞膜。显微镜应放置在防振台上,因为任何移动都可能对微电极和细胞膜之间的封接造成致命影响。
需要使用显微操作臂来精确移动微电极。加热并拉长小型玻璃或石英毛细管可以形成极细的微电极管。电极管吸头的直径约为1微米,其中包含的膜片仅含几个(甚至一个)离子通道。微电极管吸头需要在熔融状态进行热抛光,以便在吸头接触到细胞膜后实现高阻抗封接。电极管中含有类似于胞外溶液或细胞质的溶液,具体取决于记录模式。微电极安装在显微操作臂上,可以向细胞膜精准移动。
为了检测电流,使用了氯化银线。同样采用氯化银线(作为银/氯化银电极)的浴电极设置为零电流值。带低噪声晶体管的差分放大器连接到计算机,以进行数据采集和数字化,可以采购特定软件来控制该放大器并分析数据。或者,可以使用示波器来监测电流。如有需要,可以为该配置添加灌注系统。特定物质可以通过灌注笔或使用POC(灌注开关)室添加。