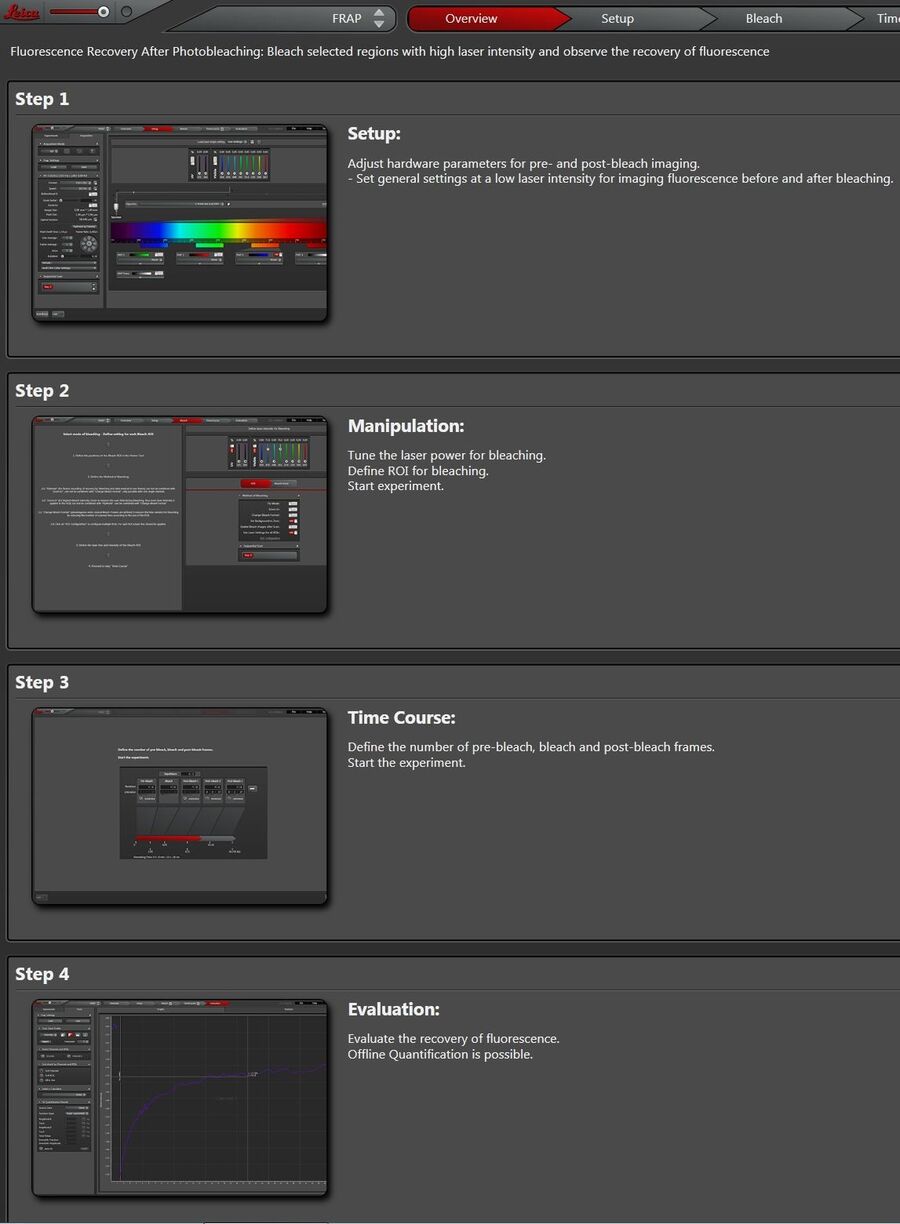
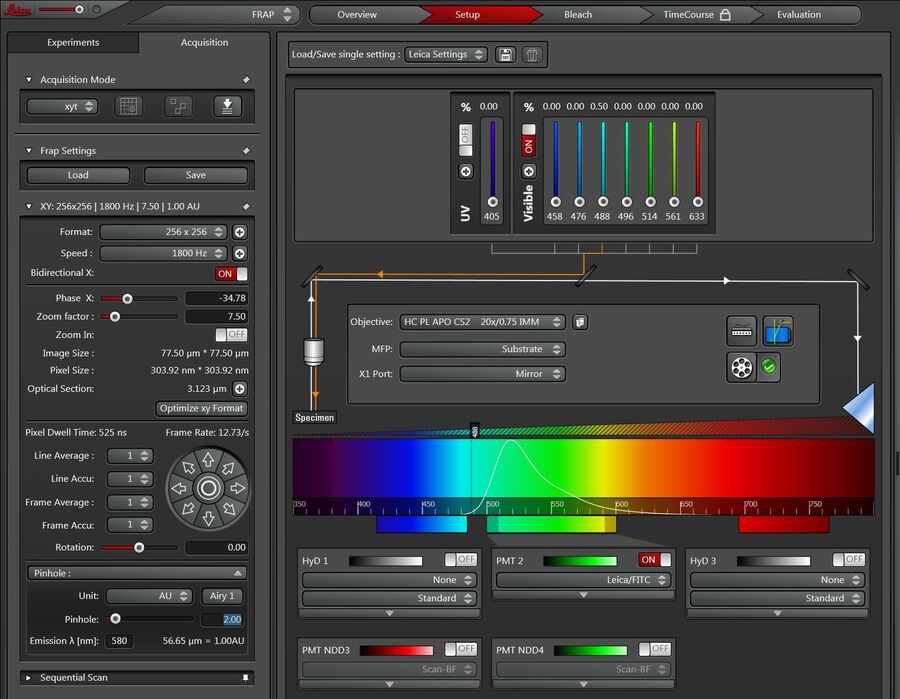
在向导界面的顶部,各工作步骤显示成按钮:“Overview”(概述)、“Set Up”(设置)、“Bleach”(漂白)、“Time Course”(时间过程)、“Evaluation”(评价)(图2)。
“Overview”概述当中提供了向导的说明并解释了每一个步骤所应进行的操作。
成像
首先要描述具有放大功能的FRAP例行程序:
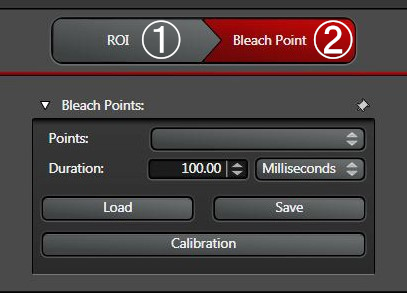
点击“Setup”设置按钮(见下图3)来为预光漂白和后光漂白调节硬件参数。
请注意:
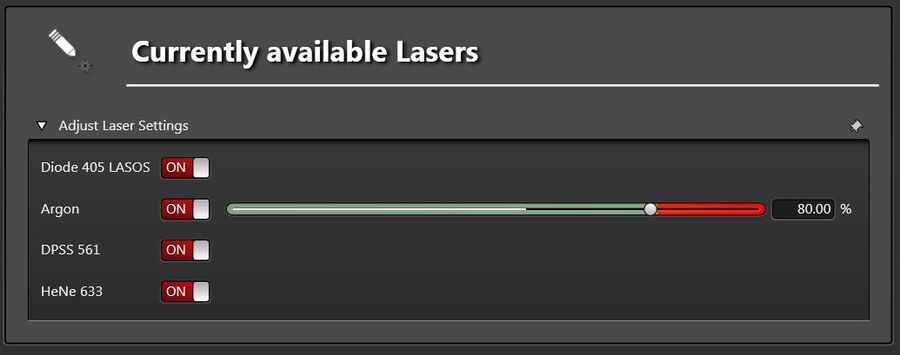
在配备混合探测器(HyD)的TCS SP8系统上建议使用PMT作为FRAP实验的首选探测器。在光漂白过程中,感兴趣区域(ROI)内通常达到高强度水平,这可能导致HyD探测器关闭以保护其免受光子过载的影响。由于随后必须主动打开检测器,否则光漂白序列将丢失而且无法进行量化。
扫描模式
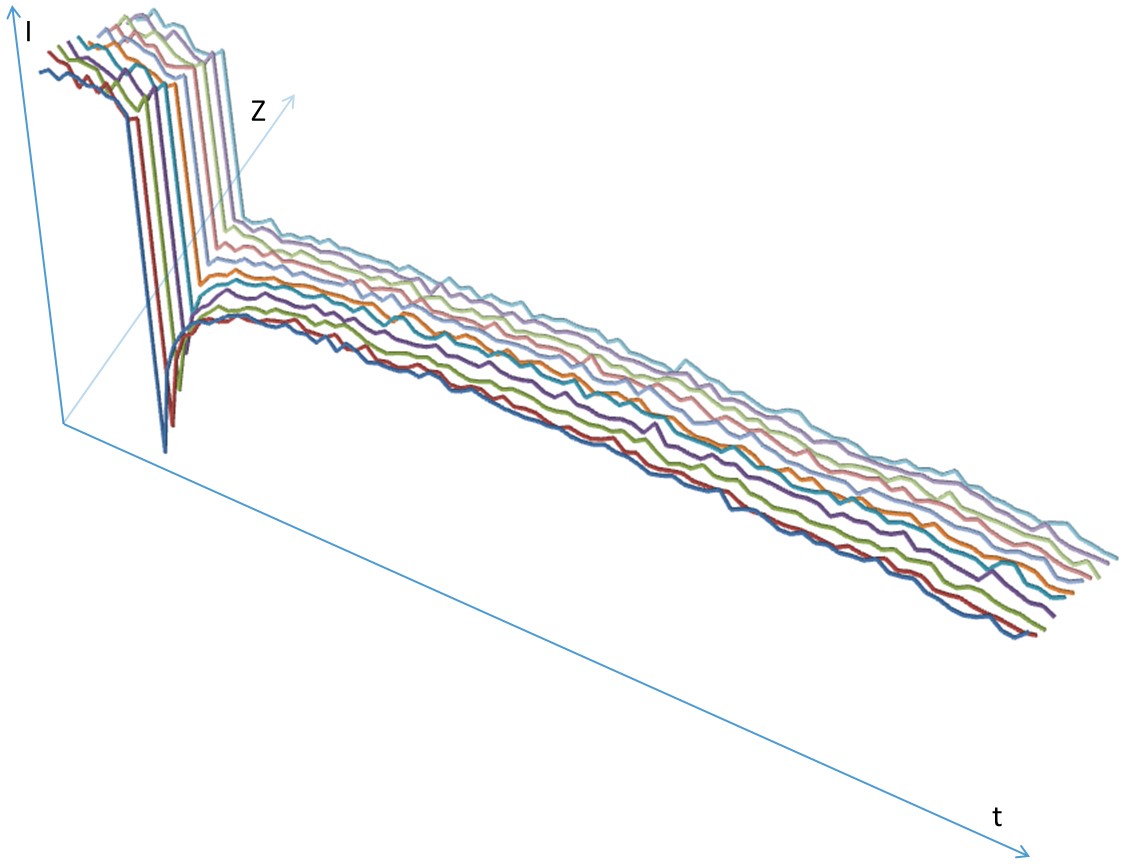
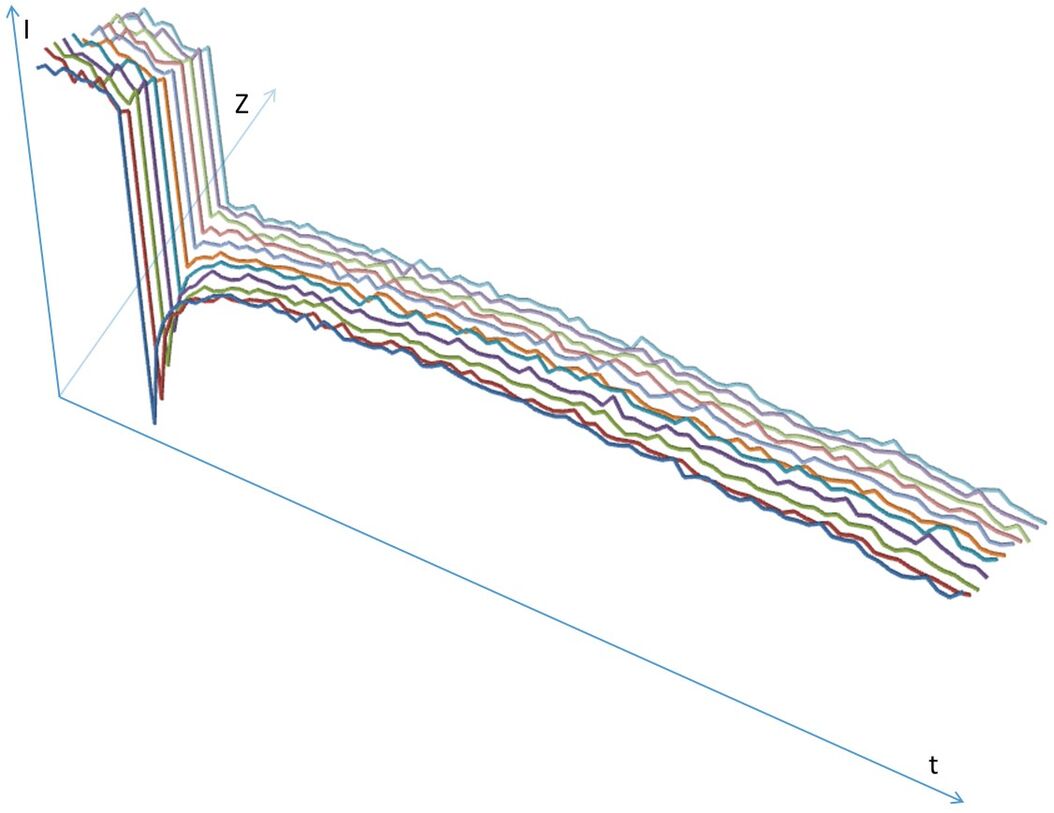
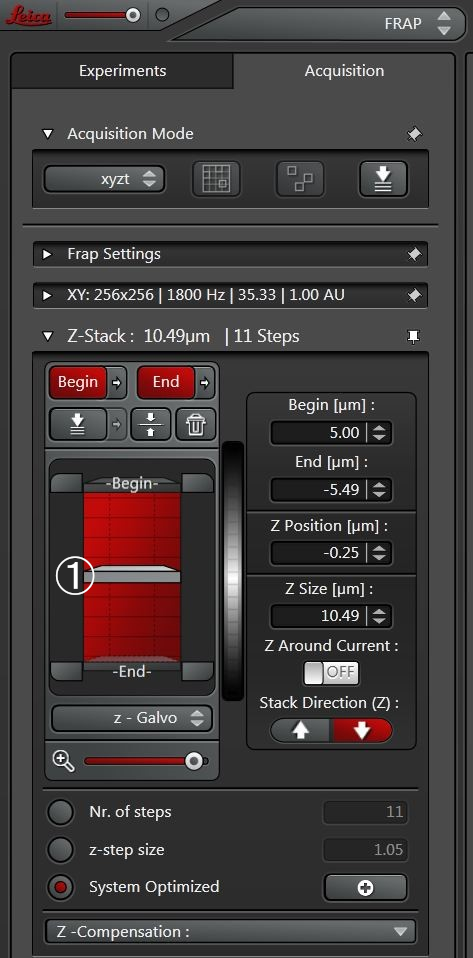
如果3D堆栈应当予以更加细致的分析,则可以将扫描模式从xyt变更为xyzt(图4)并分析一段时间内的整个z堆栈。然后在xyzt模式中对预光漂白和后光漂白序列进行扫描,堆栈内一个平面的光漂白可进行定义。
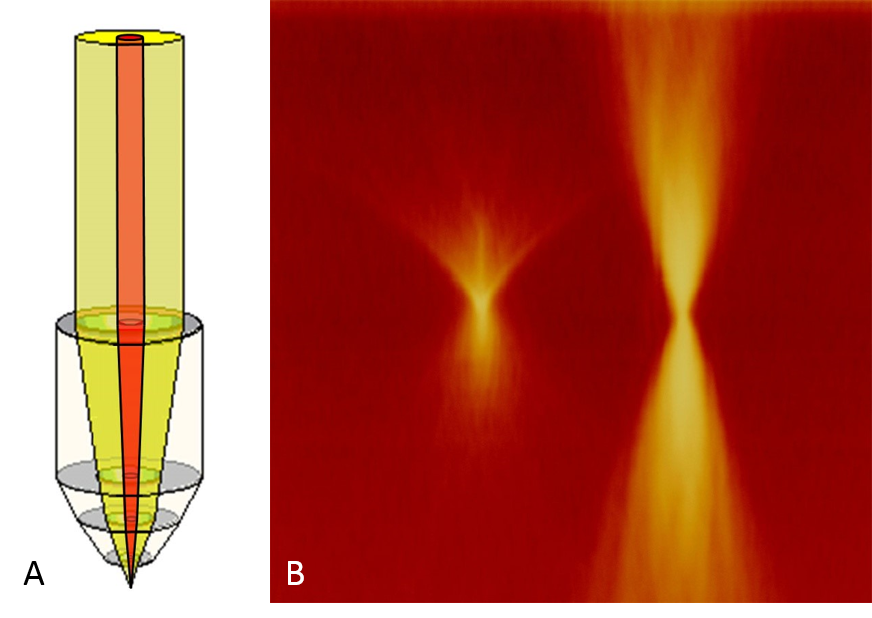
如果该选项已激活,则扩束器从光束路径上撤回。因此,物镜的后光圈不再完全充满光(见图9A)。进入物镜的光量是相同的,但集中在中心的一个点上,根据物镜的不同,光的强度大约要大2到5倍(见图9B)。事实上,使用FRAP加速器选项,可以用多种光强度(更集中的光与不集中的光)照亮。
针孔大小
处理较薄的细胞层时,您可以将针孔大小设为2个艾里单位或以上。将针孔打开可改善信噪比,且您将收集到样本更深入的动力学信息。
请注意:
将强度设置为低于饱和但略高于零,因为零值设置可能会干扰数据分析。适当的查找表(辉光上方/辉光下方)有助于调整增益/偏移。确保所有实验使用相同的增益设置。为了再现性,建议现在或最后一步保存(图10)设置、漂白和时间过程选项卡中的所有设置。然后所有硬件设置,包括ROI形状和位置等都将得到存储。
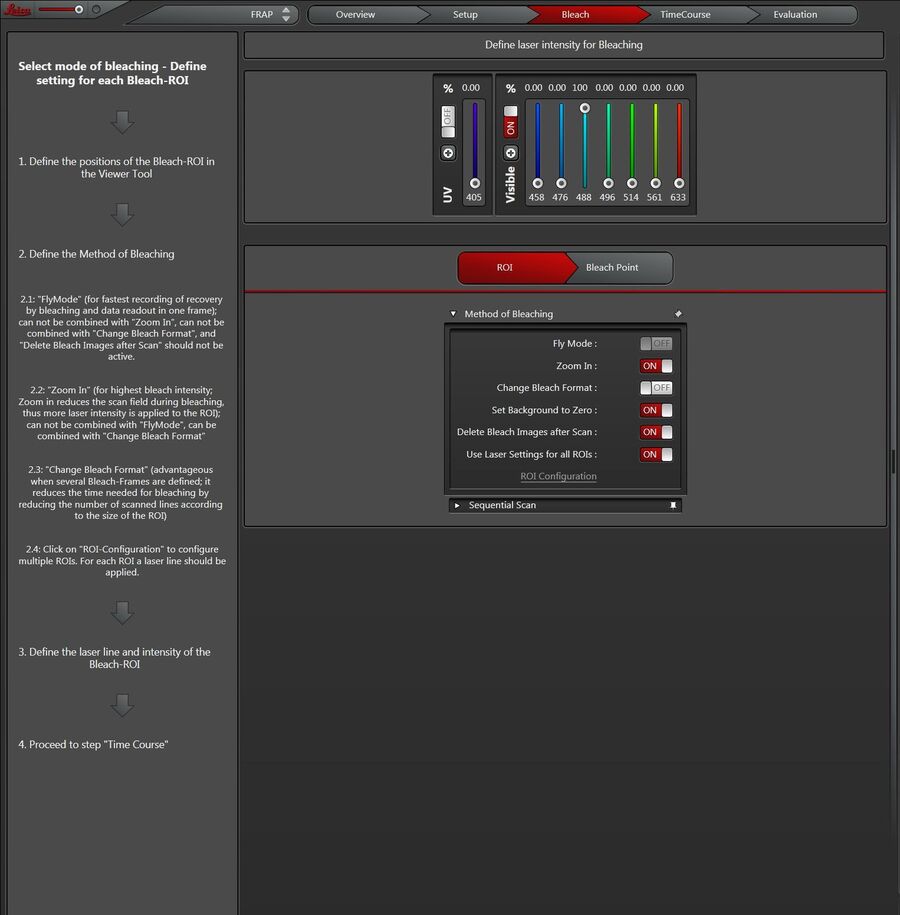
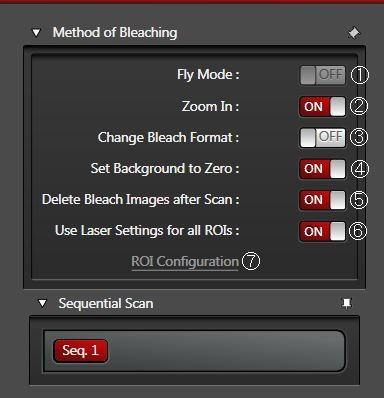
Flymode(飞行模式)①
为整个FRAP系列提供更快的时间分辨率。取代逐帧时间分辨率后可以实现逐行时间分辨率。您可以将时间分辨率降低到0.35 ms,因为恢复测量已经在行间而不是帧间完成。这一事实意味着恢复测量开始时尽可能接近零时(t0)。
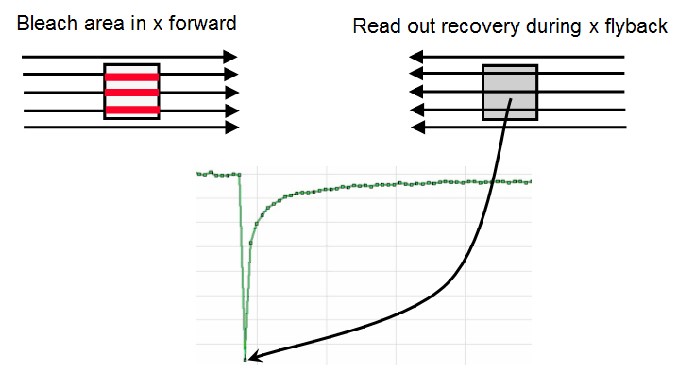
FlyMode(飞行模式)结合了光漂白扫描和光漂白后的第一次图像扫描(图14)。光漂白在前进运动中使用感兴趣区扫描()ROI)功能和高激光功率一起执行。在回扫期间,激光强度设置为成像值(AOTF开关以微秒为单位进行工作)。因此,与光漂白帧同时获取第一图像。所以,漂白和数据采集之间的延迟时间小于扫描一行所需时间的一半。
将背景设为零值 ④
启用“Zoom In”或“Flymode”时推荐该选项。
放大:
通常ROI外部区域会在背景强度下曝光。如果放大图像,这种背景强度会造成光漂白。使用“设置背景为零”,曝光的ROI外部区域将不会接收到光。
FlyMode:
FlyMode(飞行模式)处于活跃状态时,您会获得前进通道和回扫通道(见以上内容)。使用“将背景设为零值”时,前进通道将不会再预漂白和后漂白期间看到光线。只有在光漂白步骤期间,前进(左)通道才会有光进入到ROI内。
共振扫描模式下有效光漂白的预状态调节
如果需要非常快速的扫描模式(例如,测量水介质中的扩散),您可以采用512 × 128格式进行双向扫描,这会让每帧的时间变得非常短,即12 ms。这里建议应用多个光漂白帧,例如三个或四个,以应用足够的光进行光漂白。
因照明时间太短导致光照太少时可进行补偿,您可以使用:
- 光漂白期间的放大(使用TCS SP8系统,共振扫描头也可以提供放大)[FRAP可变焦距镜头]。
- 设置中的FRAP加速器选项。
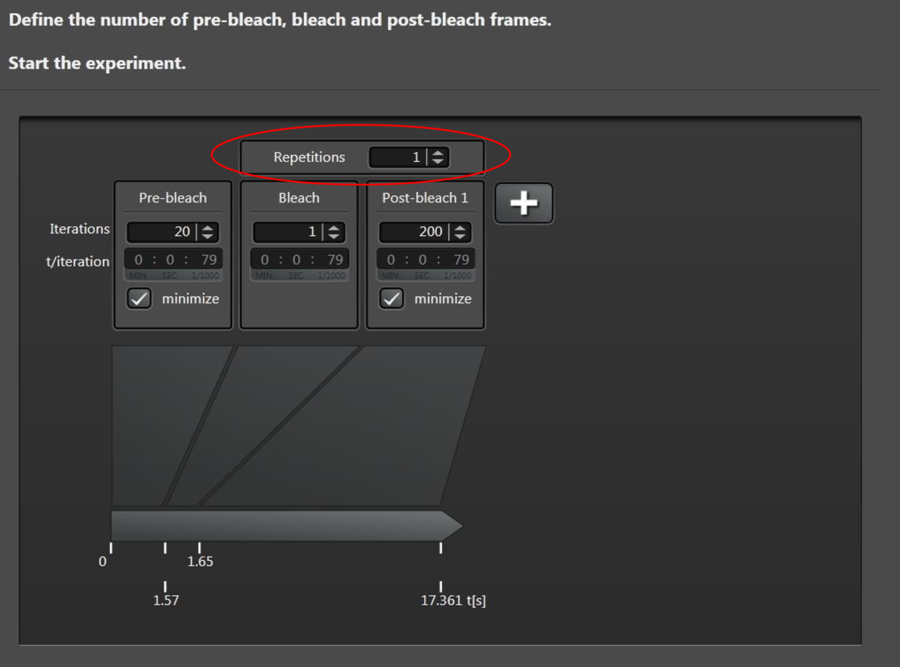
步骤3:时间过程 – 定义预漂白、漂白和后漂白间期的数量
接下来选择时间过程(图15)来定义预漂白、漂白和后漂白间期的数量。1800 Hz扫描速度(双向扫描)的典型实验和256 × 256格式可以定义如下:
您也可以通过单击“+”来添加其他时间刻度。如果需要,实验可以在中途停止,例如在漂白后。然后将引导用户进入评估步骤。如果完全恢复的总时间未知,则此功能特别有用,因为该功能可允许用户在达到完全恢复(即强度不再增加)后立即在漂白期间结束实验。换句话说,不需要等到获得了预测的帧数。
| 帧数 | 最小时帧 | 每帧时间 [ms] |
预漂白 | 10 | 是 | 79 |
漂白 | 1 | 是 | 79 |
后漂白1 | 100 | 是 | 79 |
后漂白2 | 10 | 否 | 1000 |
后漂白3 | 10 | 否 | 5000 |
表1:预漂白、漂白和后漂白步骤中的总帧数和帧速参数。