最常用的后染色方法是先用醋酸铀(UA)染色,再用柠檬酸铅染色的两步法。醋酸铀以水溶液或酒精溶液的形式使用,饱和溶液的 pH 值在 3.5 至 4.0 之间。加入酒精(尤其是甲醇)可增加其溶解度(Hayat,2000 年)。醋酸铀能对蛋白质、核酸和磷脂进行强染色。在醋酸铀染色后,使用柠檬酸铅(根据雷诺兹,1963 年的方法制备)能够增加衬度(Dykstra,1992 年)。染色可以手动或自动进行,两种技术各有优势。手动染色时,将有超薄切片的载网面朝下,漂浮在一滴醋酸铀溶液上 10 分钟。吸掉染色剂后,用水彻底冲洗载网,以去除残留的未结合染色剂。之后进行 5 分钟的柠檬酸铅染色,步骤类似。手动染色试剂消耗量极少,但工作量相对较大。
另外,也可以自动进行后染色。虽然自动染色试剂用量较多,但可确保提高重现性并节省时间。使用自动染色设备 EM AC20(徕卡显微系统公司,维也纳),每次运行可同时对多达 20 个载网进行染色,不仅操作简便,还能保证环境和用户的安全。尽管 UA 是一种性能卓越、特征明显的染色剂,但出于多种原因,人们仍在寻找替代品。
当需要在粉末状态下对其处理时,会有吸入后会剧毒并致癌的风险。此外,贫化铀醋酸酯也被视为放射性物质,因此必须遵守相关规定。因此,UA 需要正确的储存和小心的处理,这反过来又增加了运输和废物处理的成本。为了最大限度地减少接触,许多用户更倾向于使用 AC20 自动版本,尤其是因为它可以提供现成的溶液,从而避免接触 UA粉末。
文献中描述的两种可替代 UA 的试剂引起了我们的关注:乌龙茶提取物(OTE)和铂蓝。有关它们的报导较少,电镜学界对这些方法也不甚了解。因此,我们测试了手动和自动染色法,并首次使用 Leica EM AC20 仪器进行了测试。
为了直接比较不同染色后的结果,所有测试都使用相同的样品:用 2.5 % 戊二醛(100 毫摩尔/升索伦森磷酸盐缓冲液)固定刚从小鼠身上剥离的肝组织,并用 2.0 % 四氧化锇进行后固定。组织片脱水后嵌入 Agar 100 环氧树脂中,并切成厚度为 70 nm 的超薄切片。后染色的操作如下所述。除了与UA染色进行效率和结果对比外,还对其他一些重要参数进行了评估。
乌龙茶提取物
Sato 等人将 OTE 描述为电子显微镜的后染色。(2003),并在少数研究中使用(Sato 等人,2008 年;Miller 和 Simakova,2010 年)。根据 Rumpler 等人的研究(2001) 指出,OTE 是一种半发酵茶,作为食品生产。因此,尽管供应商未能提供材料安全数据表,但仍假定它对健康和环境无害。它可以从Ted Pella购买,以粉末状发货。根据 Sato 等人的研究(2003),OTE 中的多酚成分会与肽键发生反应。OTE 和柠檬酸铅的反应会增强衬度。
在对不同浓度的 OTE 进行测试后,按照 Sato 等人的建议,使用溶解在沸腾的ddH2O中的 0.2 % OTE 进行进一步实验。2003.与传统的醋酸铀染色相比,手工进行OTE和柠檬酸铅染色步骤更耗时(表 1)。Leica EM AC20 在室温下使用扩展程序也能获得最佳结果(表 2)。
表1:手动染色程序步骤
| 染色 1 | 时间 | 清洗 | 染色 2 | 时间 | 清洗 |
|---|---|---|---|---|---|
| UA | 10 分钟 | 2 分钟ddH2O | 柠檬酸铅 | 5 分钟 | 2 分钟ddH2O |
| OTE | 25 分钟 | 6 分钟ddH2O | 柠檬酸铅 | 5 分钟 | 2 分钟ddH2O |
| Pt Blue | 10 分钟 | 2 分钟ddH2O | 柠檬酸铅 | 5 分钟 | 2 分钟ddH2O |
表2:Leica EM AC20 的自动染色程序。UA 和柠檬酸铅的使用条件,可在染色设备的用户手册中找到。
| 染色 1 | 时间 | 清洗 | 染色 2 | 时间 | 清洗 |
|---|---|---|---|---|---|
| UA | 30 分钟 | 2 分钟 20 秒ddH2O | 柠檬酸铅 | 7 分钟 | 2 分钟 20 秒ddH2O |
| OTE | 40 分钟 | 5 分钟ddH2O | 柠檬酸铅 | 7 分钟 | 2 分钟ddH2O |
| Pt Blue | 30 分钟 | 2 分钟 20 秒ddH2O | 柠檬酸铅 | 7 分钟 | 2 分钟 20 秒ddH2O |
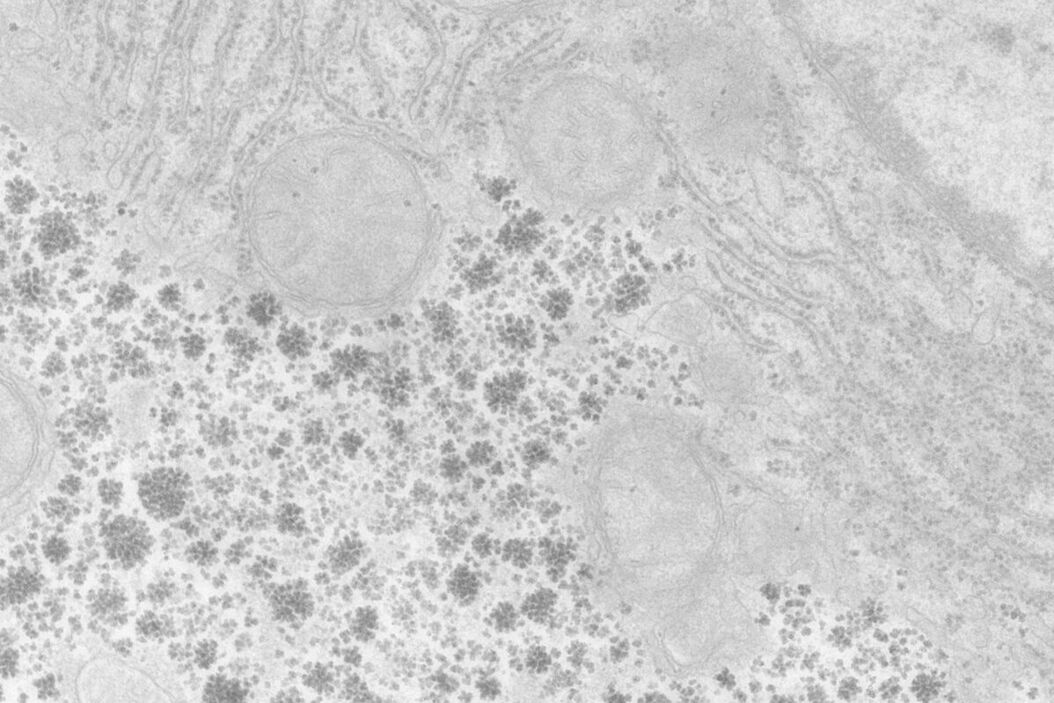
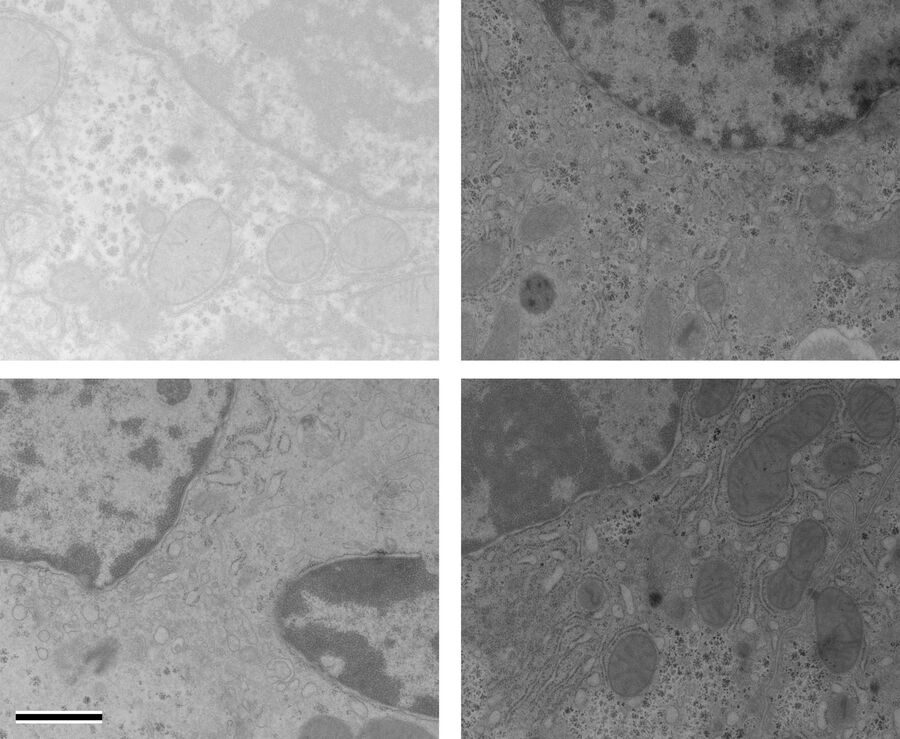
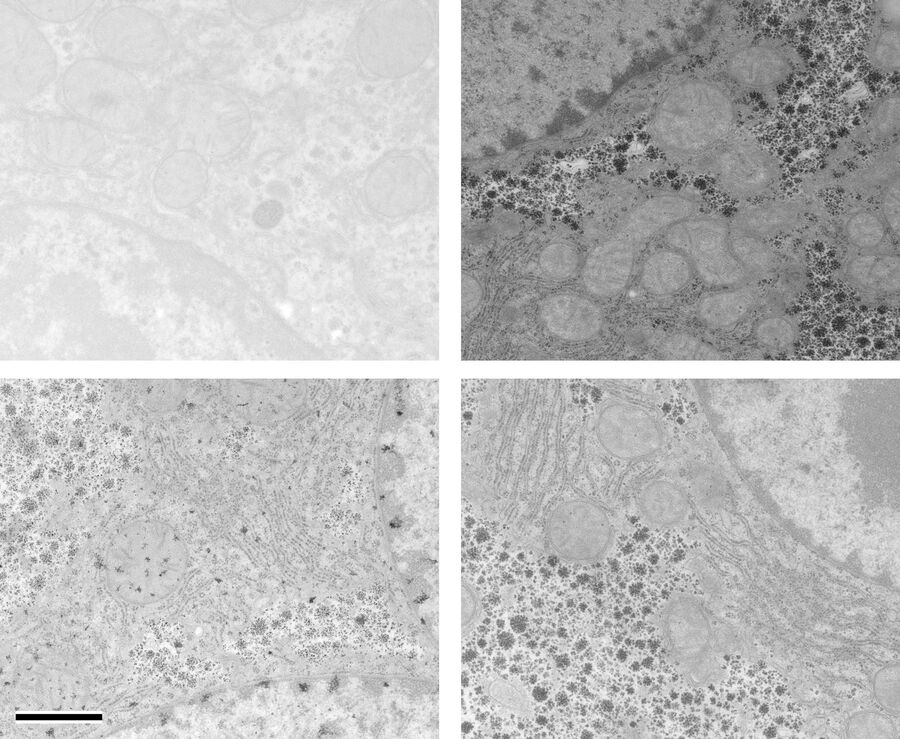
当 OTE 浓度为 0.2 % 时,手动和自动染色样品的衬度都有所提高,但明显低于 UA(图 1 和图 2)。在我们结果中,OTE染色污染比 UA 更常见,这主要是在放大倍数较低时出现的问题。尽管使用手动染色或 Leica EM AC20 延长了清洗步骤,但仍无法消除这一问题。
铂蓝
Inaga 等人使用铂蓝(Pt Blue)替代醋酸铀酰进行超薄切片后染色。2007 – 2009这种化合物是顺式二氯氨铂(II)与胸腺嘧啶反应的产物(Inaga 等人,2007 年)。该试剂可直接向日本生产商 Nisshin(http://nisshin-em.co.jp)订购。Pt Blue是一种有害物质,可能会刺激眼睛、致癌、影响生育能力以及严重的骨髓、肾脏和神经系统疾病(MSDS Nisshin)。市售的 6% 原液在手动染色时稀释比例为 1:100,在自动程序中稀释比例为 1:200,最后结果都很好。手动染色法的孵育时间与 UA 染色法相同(参见表 1)。
使用 Leica EM AC20 染色时,Pt Blue的步骤延长至 30 分钟,条件与 UA 相同。然后用蒸馏水冲洗载网,用柠檬酸铅染色,并按表 2 所述方法清洗。由图 1 和图 2 可知,经两种染色方法处理后,所有细胞器都显示出良好的衬度,Pt Blue与 UA 染色的超薄切片图片质量相当。两种染色方法不同之处在于,Pt Blue染色的线粒体基质和糖原颗粒衬度更高。与 UA 相比,核糖体的染色衬度更弱。
结论
在电子显微镜测试后染色的超薄切片实验,对 OTE 和Pt Blue作为 UA 替代品的对比效果、毒性、操作和价格进行了评估。此次也测试了 手动染色方法和使用Leica EM AC20 的自动染色程序。本次测试没有进行前染色方法测试。此外,Agar 100 以外的树脂或不同的切片厚度可能会导致不同的结果。
结果显示,无论使用手动染色或者Leice EM AC20的自动染色,使用 OTE 所获得的衬度均较弱,并且观察到标本污染情况。Pt Blue 采用手动和自动这两种方法,都取得了明显更好的效果。不过,在分析电子显微镜结果时,必须考虑到Pt Blue与 UA 相比衬度特性的细微差别(Yamaguchi 等人,2010 年)。对于 OTE 和Pt Blue来说,自动染色的结果可与手动染色相媲美。
在毒性方面,作为 UA 替代品进行测试的两种试剂都具有无放射性的优点。此外,这两种试剂还可以避免使用有害健康的可吸入粉末。作为一种食品,可以推定 OTE 是无害的。相比之下,Pt Blue是有毒的,但由于它是以溶液形式出售的,因此可以将进一步的处理风险降到最低。使用 Leica EM AC20 自动染色设备,有助于进一步减少与有毒试剂的接触。
用 UA 和Pt Blue染色,在时间和人力上都不相上下,而用 OTE则更费时,但效果却不尽如人意。通过使用 Leica EM AC20 ,它可以同时对多达 20 个载网进行染色,并且所有步骤都是自动执行的,这就降低了OTE耗时的缺点。从经济角度看,OTE 是迄今为止最便宜的产品。使用OTE时,每个载网的使用成本明显低于使用浓度为 0.2 % 的Pt Blue(稀释比例为 1:100)和 2.0 % 的 UA 溶液。
总之,电子显微镜专家需要用一种试剂(乌龙茶提取物)来替代 UA 对切片进行后期染色,这种试剂价格低廉,风险极小,但效果一般;另一种试剂(Pt Blue)效果令人信服,但成本较高,而且存在安全隐患。上述实验表明,这些染色试剂均适用于手动染色和自动染色仪
徕卡 EM AC20
参考资料
- Dykstra MJ:生物电子显微镜:理论、技术和故障排除。Plenum Press,纽约(1992 年)。
- Flegler SL, Heckman JW Jr, Klomparens KL:扫描和透射电子显微镜:简介。W.H. Freeman and Company,纽约(1993 年)。
- Hayat MA:电子显微镜原理与技术:生物应用。第 4 版。剑桥大学出版社,剑桥(2000 年)。
- Inaga S, Hirashima S, Tanaka K, Katsumoto T, Kameie T, Nakane H, Naguro T:Low vacuum scanning electron microscopy for paraffin sections utilizing the differential stainability of cells and tissues with platinum blue.Arch Histol Cytol 72:2 (2009) 101-106。
- Inaga S, Katsumoto T, Tanaka K, Kameie T, Nakane H, Naguro T:Platinum blue as an alternative to uranyl acetate for staining in transmission electron microscopy.Arch Histol Cytol 70:1 (2007) 43-49。
- Miller AA., Simakova AV:Application of Method of OTE Staining of Ultrathin Sections Based on Example of Microsporidia (Protozoa:Microsporidia).Cell and Tissue Biology 4:1 (2010) 109–115.
- Reynolds ES:The Use of Lead Citrate at High pH as an Electron Opaque Stain in Electron Microscopy.Journal of Cell Biology 17 (1963) 208–212.
- Sato S, Adachi A, Sasaki Y, Ghazizadeh M:Oolong tea extract as a substitute for uranyl acetate in staining of ultrathin sections.Journal of Microscopy 229:Pt 1 (2008) 17–20.
- Sato S, Sasaki Y, Adachi A, Dai W, Liu XL, Namimatsu S:Use of oolong tea extract (OTE) for elastin staining and enhancement in ultrathin sections.Med Electron Microsc 36:3 (2003) 179-182.
- Rumpler W、Seale J、Clevidence B、Judd J、Wiley E、Yamamoto S、Komatsu T、Sawaki T、Ishikura Y、Hosoda K:Oolong Tea Increases Metabolic Rate and Fat Oxidation, in:Men J Nutr 131 (2001) 2848-2852。
- Yamaguchi K, Suzuki K, Tanaka K:Examination of electron stains as a substitute for uranyl acetate for the ultrathin sections of bacterial cells.Journal of Electron Microscopy (Tokyo) 59:2 (2010) 113–118.
Note added in proof:Readers interested in replacing uranyl acetate are also referred to Nakakoshi M, Nishioka H and Katayama E. New versatile staining reagents for biological transmission electron microscopy that substitute for uranyl acetate.Journal of Electron Microscopy 60:6 (2011) 401–407.