Carlon-Andres, I., Malinauskas, T.& Padilla-Parra, S.:
与活体 T 细胞接触的原生病毒上 HIV-1 Env 三聚体的结构动力学
Commun Biol 4, 1228 (2021)。
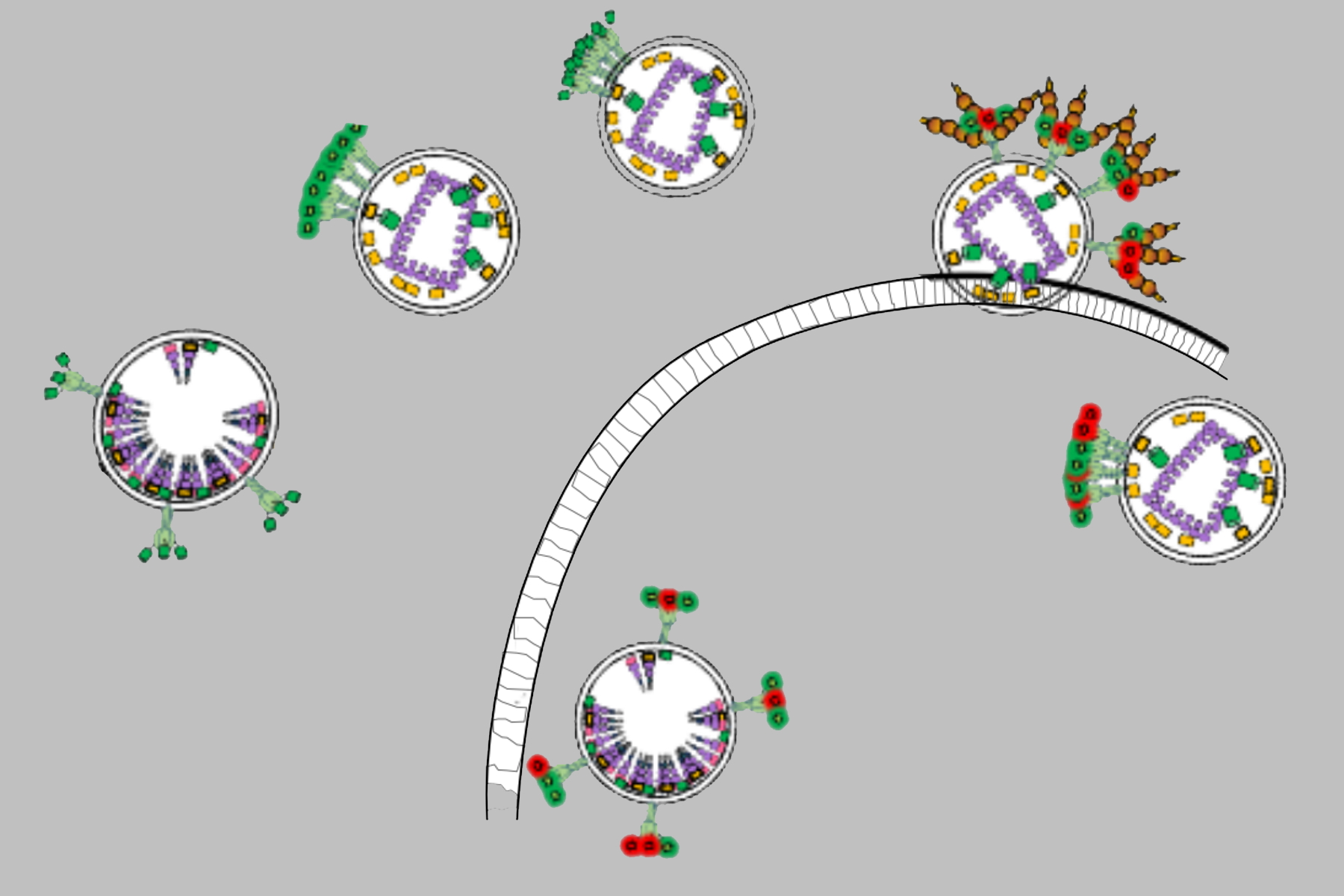
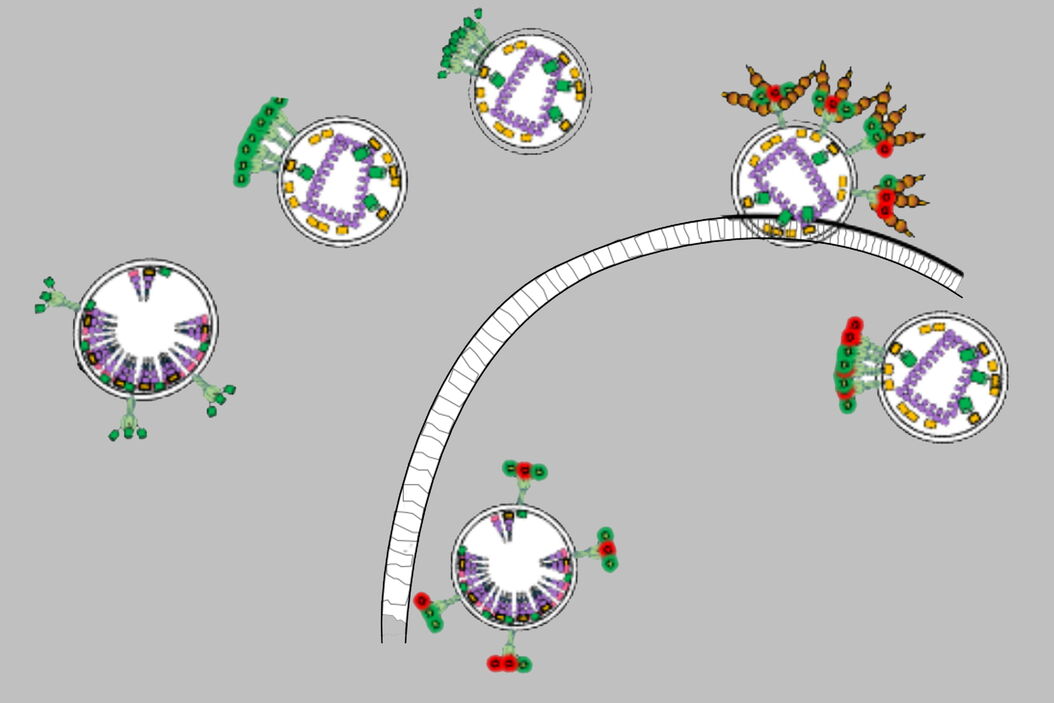
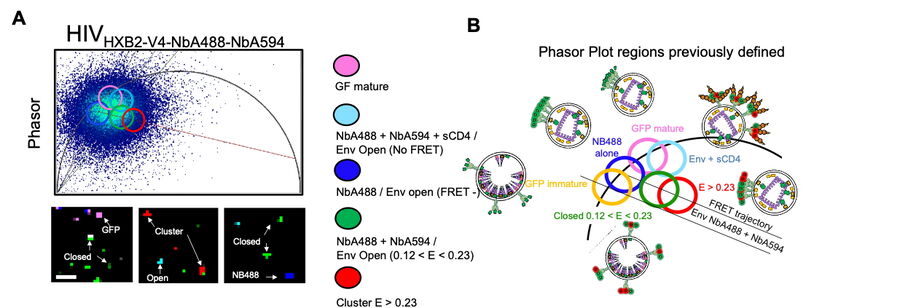
在本文中,我们重点研究Env蛋白与T细胞(HIV-1的主要靶标)相互作用时的分子机制[Carlon-Andres I 等,2021]。多光子与荧光寿命成像显微术使我们能够在原生病毒颗粒与活细胞的界面处评估该过程中的分子间与分子内动态变化。我们发现,Env簇的分布由病毒颗粒的成熟程度决定,并与Env的开合状态相关联。此外,在将T细胞与HIV-1颗粒共孵育时,我们发现不同广谱中和抗体(靶向不同表位)均能够破坏Env簇的动力学特征,而不论其所针对的Env表位如何。
这些结果表明,在HIV-1与宿主细胞结合的状态下进行成像具有重要意义。在此条件下,我们揭示了Env分子间相互作用在免疫逃逸中的关键作用。