简介
电子显微镜,包括透射电子显微镜(TEM)和扫描电子显微镜(SEM),被广泛应用于获取生物样本或非生物材料的精细结构信息。超薄切片技术是制备厚度小于100纳米的超薄切片的首选方法,适用于透射电镜/扫描电镜分析。样品制备过程中,微小样本块被包埋于环氧或丙烯酸树脂中,去除多余树脂后,使用玻璃刀或金刚石刀将标本切成超薄切片(50nm-100nm)。
为获取三维结构信息,三维电子显微技术(vEM)正日益普及。然而处理大体积样本时,常需聚焦特定目标亚体积以优化采集时间与数据量,从而提升工作流程效率。虽可通过形态特征定位目标区域(ROI),但精准识别细胞或结构通常需依赖荧光标记技术。现有多种专用分子标记物(如直接标记物与基因编码荧光蛋白),可引导超薄切片及电镜图像采集,最终实现关联光镜电镜技术(CLEM)。
徕卡显微系统超薄切片机UC Enuity可配置高倍电动立体荧光显微镜。该配置能在修块与切片过程中实现荧光可视化,支持超薄切片流程的荧光靶向定位。
尽管已开发多种CLEM工作流程,在树脂包埋样本中利用荧光识别特定目标仍具挑战性——尤其因三维扫描电镜制样所需的标准浓度重金属及环氧树脂会削弱荧光信号,导致此类方案对光学显微镜的适用性降低甚至完全失效。
为此,已开发出在样品制备过程中保存荧光的技术方案,实现对荧光标记结构的精准定位。
样品固定
为制备电镜样本,首要任务是固定样本。
本文所述方案采用物理冷冻固定替代经典化学固定技术:通过高压冷冻(HPF)使样本在毫秒级时间内瞬时冷冻,抑制冰晶形成并使水分保持玻璃态。据认为此状态最接近天然结构。细胞层可通过浸入式冷冻装置(如Leica EM GP2)实现冷冻固定;而细胞团块及厚度达200微米的样本需采用高压冷冻(如使用Leica EM ICE)[1]。
冷冻替代和染色
随后样本在−90°C或相近温度下经溶剂脱水(冷冻置换,FS),从而实现超微结构保存。相较化学固定法,FS技术被认为能提供更优保存效果。在红外荧光(IRF)技术中,脱水溶剂优选丙酮而非乙醇,但需严格控制处理时间以避免荧光淬灭。鉴于有机材料及包埋树脂电子密度较低,冷冻置换过程中需添加醋酸双氧铀(UA)、四氧化锇等重金属化合物——这些物质对蛋白质与脂质具特异性亲和力。
因四氧化锇会破坏荧光,下述方案在冷冻置换阶段采用低浓度醋酸双氧铀。
渗透和包埋
水分置换后,利用溶剂稀释树脂以促进样本渗透——这是在树脂固化前实现浸润的关键步骤。为保存荧光并避免高温固化,丙烯酸树脂(如Lowicryl® HM20或LR White)被证明是最佳选择。此外,丙烯酸树脂可在低温环境(约-20°C)下应用,有助于维持样本结构完整性。
示例方案 1 - 细胞样本
冷冻固定
高压冷冻(HPF)制备时,细胞通常培养于蓝宝石载片(玻璃载片会破裂)或以悬浮液形式直接注入样品托。标准组装及HPF方案可参考各制造商说明(如Leica EM ICE)[1] 为抑制胞外冰晶形成并提升冷冻质量,可使用冷冻保护剂。样品托组装阶段通常应用非渗透性液体,如葡聚糖(15-20%)、Ficoll®(5-20%)或纯1-十六碳烯。
冷冻置换与染色
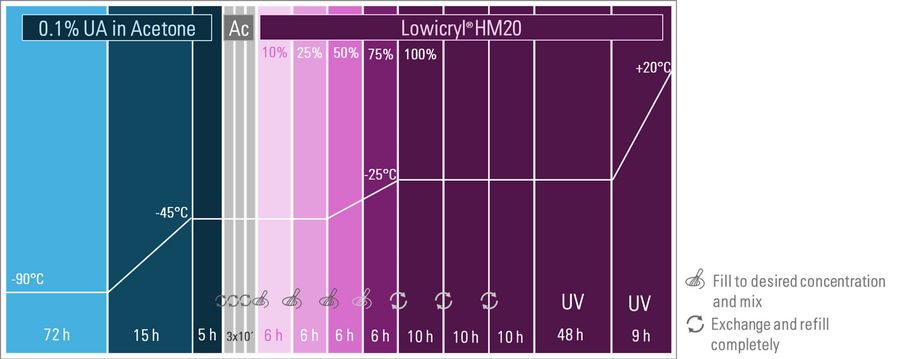
冷冻置换采用含0.1%醋酸双氧铀(UA)的干燥丙酮溶液。如前所述,根据细胞类型与UA母液来源,部分方案甚至将UA浓度降至0.04%。虽然标准方案建议在−90°C初始孵育72小时,但为缩短耗时流程,细胞样本可减少处理时长(图1)。为最大限度减少长时程方案中的人工操作,配备液体处理系统的全自动冷冻置换设备具有显著优势。徕卡研发的自动冷冻置换系统EM AFS2即为此类设备,其集成冷冻置换处理器EM FSP实现液体自动处理。
如图1所示,细胞样本在含0.1%醋酸双氧铀(UA)的干燥丙酮溶液中于-90°C处理9小时。随后温度逐步升至-45°C并维持5小时,使UA充分染色样本(具体时长视样本而定)。此后通过三次丙酮洗涤去除醋酸双氧铀,完成冷冻置换与染色。
树脂渗透与聚合
在温度升至-25°C过程中,以2小时为间隔逐步提高Lowicryl® HM20树脂浓度进行渗透。温度全程控制在-20°C以下以保护样本完整性,同时利用树脂低粘度实现高效渗透,避免蛋白质结构破坏。在三次树脂置换及后续48小时紫外聚合过程中,温度恒定为-25°C。此阶段EM AFS2系统的液体处理系统切换为自动紫外灯。最后9小时聚合阶段温度升至20°C,此时样本可进行后续修块与切片(参见荧光修块技术说明)[2]。
实例方案2——类器官与胚胎样本制备
冷冻固定
对于类器官、组织块或果蝇等模式生物胚胎等大于细胞的样本,高压冷冻(HPF)是首选方法,但样本厚度需限制在约200微米内。需选用容积匹配的样品托,避免HPF过程中存在无效空间。由于此类样本胞外空间远大于细胞,冰晶破坏风险显著增高,故更需频繁使用冷冻保护剂。
冷冻置换与染色
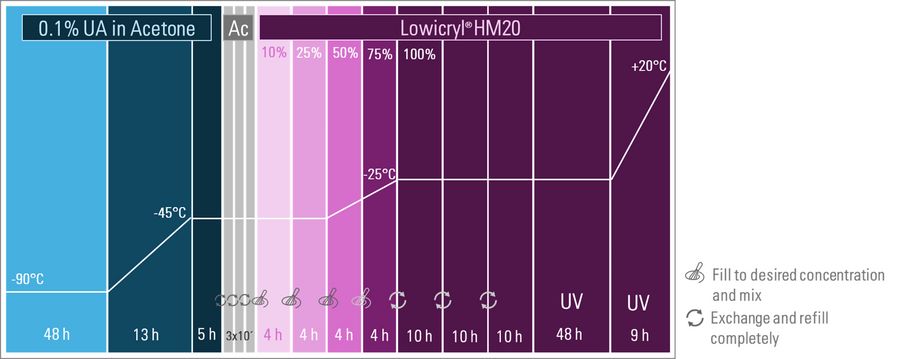
为维持荧光,冷冻置换同样采用含0.1%低浓度醋酸双氧铀(UA)的干燥丙酮溶液。胚胎或卵室样本常需穿孔处理以提升渗透效率。
如图2所示,此类样本置换阶段(-90°C)长达72小时(远超细胞样本),随后以3°C/小时速率升温。样本在-45°C继续维持5小时确保充分染色——此步骤对染色效果至关重要,且需根据样本特性调整。Ronchi等学者证实该方案适用于果蝇卵巢与幼虫、乳腺类器官等样本。
渗透和聚合
经三次干燥丙酮洗涤后,启动Lowicryl® HM20树脂梯度渗透程序——分四个6小时阶段逐步提高树脂浓度。第三、四阶段温度升至-25°C以提升渗透速率。温度全程控制在-20°C以下保护样本完整性,同时利用树脂低粘度实现高效渗透,避免蛋白质结构破坏。在-25°C条件下完成三轮置换补液式深度渗透,随后进行48小时紫外聚合。此阶段EM AFS2系统的液体处理器切换为紫外灯。最终升温至20°C确保树脂完全硬化,使样本稳定适用于后续超薄切片流程(参见荧光修块技术说明)[2]。
举例:
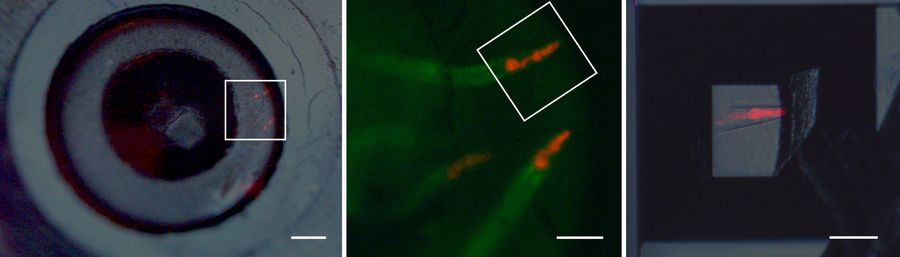
为利用荧光进行块面靶向修整及实施包埋后关联光镜电镜技术(图示略),上述方案已适配于基因表达咽部与肠道标记物的秀丽隐杆线虫样本(图3)。流通室包埋块经人工预修整后,在UC Enuity系统上自动设定含目标线虫的块面修整区域,全程无需用户干预即可完成自动修整。荧光引导自动修块详细方案参见:荧光自动修块方案 [2]。
初始置换时长为48小时,随后经13小时温度斜坡程序升温至-45°C。Lowicryl® HM20浓度梯度渗透阶段设定为4小时/级。上述时间参数根据样本特性(尺寸、表皮厚度及渗透性)的操作经验,调整至前述方案所述区间内。
总结
在本文中,我们了解到在电镜样本制备过程中可实现荧光保存。相关技术方案及核心步骤已阐明:关键环节包括高压冷冻、采用低浓度醋酸双氧铀(UA)进行冷冻置换以增强电子反差染色,最终通过丙烯酸树脂包埋完成样本制备。
该工作流程使研究人员能在超薄切片过程中利用荧光进行靶向修块,并可在切片阶段实施潜在的目标控制。尤为重要的是,仅依赖荧光引导即可高效修整目标亚体积,使电镜数据采集聚焦于目标区域,从而显著减少机时与总体成本。
红外荧光(IRF)技术还支持包埋后关联光镜电镜(CLEM)——该技术至关重要,因电镜样本制备过程中的不均匀收缩会阻碍包埋前荧光数据与包埋后电镜数据的精准关联。
致谢
作者感谢 Paolo Ronchi 和 Yannick Schwab(两人均为德国海德堡 EMBL 实验室)允许我在使用荧光修剪靶标时他们的方案。
此外,还要特别感谢 Felix Gaedke 博士(德国科隆 CECAD),感谢他制备样品并在许多方面提供知识。
C. elegans由德国科隆遗传学研究所 Thorsten Hoppe 教授提供。
IRF 原始方案和进一步阅读
- Nixon, S.J., Webb, R.I., Floetenmeyer, M., Schieber, N., Lo, H.P. and Parton, R.G. (2009), A Single Method for Cryofixation and Correlative Light, Electron Microscopy and Tomography of Zebrafish Embryos.交通》,10:131-136。
- Wanda Kukulski, Martin Schorb, Sonja Welsch, Andrea Picco, Marko Kaksonen, John A.G. Briggs; Correlated fluorescence and 3D electron microscopy with high sensitivity and spatial precision. J Cell Biol 10 January 2011; 192 (1): 111–119.
- Christopher J. Peddie, Ken Blight, Emma Wilson, Charlotte Melia, Jo Marrison, Raffaella Carzaniga, Marie-Charlotte Domart, Peter O׳Toole, Banafshe Larijani, Lucy M. Collinson; Correlative and integrated light and electron microscopy of in-resin GFP fluorescence, used to localise diacylglycerol in mammalian cells. Ultramicroscopy, Volume 143, 2014, Pages 3-14, ISSN 0304-3991.
- Biel, S.S., K. Kawaschinski, K.-P.Wittern, U. Hintze, and R.Wepf. 2003. From tissue to cellular ultrastructure: closing the gap between micro- and nanostructural imaging. J. Microsc. 212:91–99.