早期荧光观测
人类对荧光蛋白的兴趣可以追溯到公元一世纪,当时罗马自然哲学家老普林尼[1] (Gaius Plinius Secundus,公元 23 年-公元 79 年)描述了地中海中一种会发光的水母(Pulmo marinus)。在他眼中,这些动物发出的光如此强烈,几乎可以用作火炬(Bohn,1855 年)。除了这种水母之外,还有大量其他生物因为在黑暗中发光而吸引了我们的注意。事实上,它们发光并不是为了吸引我们的眼球,而是为了与同类交流(如萤火虫对其配偶施加拉力)、吸引猎物(如蛙鱼)或吓唬捕食者(如长尾乌贼)。这些迷人的生物中有一些生活在黑暗的世界--例如深海--在那里光是一种原始属性。只有海洋的上层 200 米才有阳光,而在这一边界之下,唯一存在的光照是由生活在那里的生物产生的。
利用化学发光和荧光发光,进化出了近代生物化学和细胞生物学中最令人印象深刻和最强大的工具之一。他们的努力和发现值得一提。
中世纪后,随着人们对自然科学的兴趣日渐浓厚,西班牙医生兼植物学家尼古拉斯-莫纳德斯(Nicolás Monardes)等人于 1565 年描述了一种由 Lignum nephriticum 提取物制成的会发光的木材。后来,这种光被归因于这种植物中的一种黄酮类化合物的氧化产物,并表明发光不仅限于动物。三个多世纪后(1858 年),爱尔兰数学家和物理学家乔治-加布里埃尔-斯托克斯为这种自然现象起了一个名字: 荧光。他根据能发出蓝光的矿物萤石想到了这个词,并扩大了对辐射物体的观察范围,从动物到植物,再到石头。
绿色荧光蛋白的突破
日本生物化学家下村治(Osamu Shimomura)是现代最早开始系统探索荧光蛋白的研究人员之一。他与老普林尼一样对荧光水母感兴趣,并在 20 世纪 60 年代初将维多利亚水母(Aequorea victoria)确立为自己的 "心仪之物"。下村之所以对维多利亚水母如此着迷,是因为它能通过荧光发出绿光。它的栖息地在太平洋,以贝类和其他水母为食。这种光是由生物体底部呈环状排列的所谓发光器官产生的。下村在毕业时曾对一些种虾的荧光素进行过研究,他解剖了这些器官并用筛子挤压,结果得到了微弱发光的浆液。通过对成千上万只水母的研究,下村的努力得到了回报,他提取并纯化出了化学发光蛋白aequorin[2]。后来人们发现,aequorin之所以能发出蓝光,是因为它在钙依赖反应中作为荧光素酶参与了腔肠素的氧化过程。荧光素酶是一种在化学反应中氧化底物(荧光素)的酶,与光的发射有关。
GFP 通往诺贝尔奖过程的下一个突破性步骤要等到 20 世纪 70 年代克隆技术的发明。1992 年,美国微生物学家 Douglas Prasher 首次克隆出完整的 GFP 基因[3]。在此之前,他与佐治亚大学的同事米尔顿-科米尔(Milton Cormier)一起准备了一个维多利亚甲虫 cDNA 文库,已经知道了 GFP 的前景。遗憾的是,在他开始在细菌中表达重组 GFP 之前,美国癌症协会(American Cancer Society)对 Prashers 的资助就已经用完。
美国生物学家马丁-查尔菲(Martin Chalfie)最初怀疑 GFP 无法在水母之外发挥作用,但他从普拉舍的初步工作中获益匪浅。通过将 GFP 基因导入大肠杆菌和线虫 C. elegans,他可以证明没有其他水母特有的蛋白质或因子可以产生绿光[4]。
活细胞成像中的 GFP
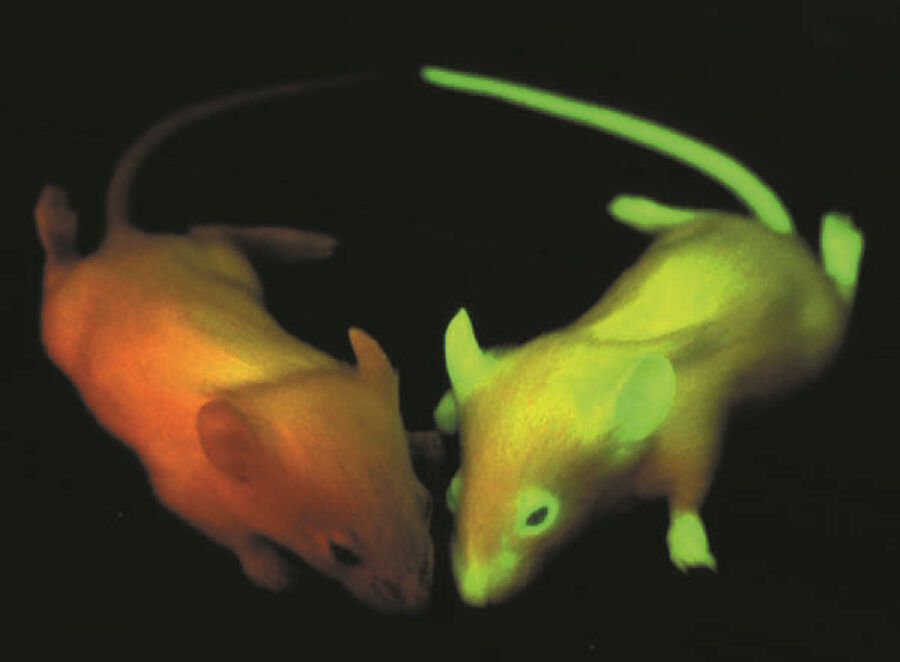
有了这些经验,绿色荧光蛋白在生命科学领域开始了它惊人的事业。GFP 成为观察活细胞和生物体结构的关键,而无需合成标签或荧光抗体。在免疫荧光染色的情况下,必须保证抗体能够进入细胞内的相应目标结构。要做到这一点,就必须用去污剂(例如)使细胞通透,这不可避免地会导致细胞死亡。此外,大多数抗体都偏爱变性抗原。因此,免疫荧光技术使用对羟基甲醛等制剂使细胞蛋白质目标结构变性。总之,GFP 的使用可以克服这些非生理条件,为生命细胞成像铺平道路。
罗杰-钱(Roger Tsien)是另一位意识到并开发 GFP 巨大潜力的人。这位美国细胞生物学家来自钙调节领域,他对追踪活细胞内大分子的相互作用产生了浓厚的兴趣。在哈佛大学、剑桥大学和伯克利大学学习和工作后,他最终在加州大学圣地亚哥分校安顿下来。作为药理学、化学和生物化学教授,他利用进化过程中一个非常普遍的原理,提高了 GFP 的效率: 突变。1994 年,他和他的研究小组发现了一种 GFP 的单点突变体(S65T),其发光强度和光稳定性比野生型要好得多。除了发光更亮之外,S65T 突变体还有另一个显著的技术优势。野生型 GFP 在 395 纳米和 475 纳米有两个激发最大值,而突变型只有一个,即 484 纳米。通过将其发射波长保持在 509 纳米,"新 "GFP 的光谱特性几乎符合经典的 FITC 荧光特性(FITCex:496 纳米,FITCem:520-530 纳米)。由于这种 GFP 变体具有增强功能,因此被称为 "增强型 "GFP 或 EGFP。
通过对 GFP 的结构研究,Tsien 及其同事开发出了更多的荧光衍生物。他们掌握了 GFP 的结构,并确定了一种变体(T203Y),这种变体闪耀着明亮的黄色,因此被命名为 "黄色荧光蛋白 "或 YFP。随后又出现了青色(CFP)和蓝色(BFP)形式的荧光蛋白 [5]。
珊瑚中的荧光蛋白
自 2003 年起担任俄罗斯科学院通讯院士的生物化学家谢尔盖-A-卢基扬诺夫(Sergey A. Lukyanov)在珊瑚中发现了红色荧光蛋白[7],从而将荧光蛋白的颜色范围扩展到了光谱的红色范围。卢基扬诺夫在莫斯科一家宠物店购买了一些珊瑚虫后,对这些准备用于俄罗斯海洋水族馆的原始动物的荧光行为进行了研究。其中,他从珊瑚虫 Discosoma 中发现了一种红色荧光蛋白,并将其命名为 DsRed。除了 DsRed,卢基扬诺夫和同事们还在拟水生动物中发现了一系列其他发光蛋白,并不断对其进行优化,以用于生物化学研究。
诺贝尔奖
研究人员在发现、理解和增强荧光蛋白方面所做的努力,为生命科学带来了巨大的应用空间。GFP 及其变体为科学家观察生物体内的转移或血管生成等情况打开了大门。此外,荧光多色神经元(Brainbow)的使用将有助于了解大脑中复杂的神经元网络。由于可以用荧光蛋白装饰寄生虫(如疟疾病原体恶性疟原虫),因此可以观察它们在宿主细胞中的命运。这样的机会不胜枚举,不仅包括临床相关项目,还包括其他基础科学项目。
GFP 及其突变体的使用极大地改变了我们对生命及其病理变化的看法,因此,参与发现和开发 GFP 的三人获得了 2008 年诺贝尔化学奖。Osamu Shimomura、Martin Chalfie 和 Roger Y. Tsien 因其在 "发现和开发绿色荧光蛋白 GFP "方面的工作而获得了科学界的最高荣誉。
www.nobelprize.org/nobel_prizes/chemistry/laureates/2008/
在以 Måns Ehrenberg 教授为代表的诺贝尔化学奖委员会(2008 年)看来,"......绿色荧光蛋白 (GFP) 的发现和发展从根本上改变了科学议程。绿色荧光蛋白和类绿色荧光蛋白的改良变体与高分辨率显微镜、计算技术和强大的理论方法协同作用,正在推动一场以复杂生物系统定量分析为重点的科学革命。一个由迄今为止从未见过的结构和动态原理组成的世界正在逐步显现,并对生物、医学和制药研究的几乎所有方面产生影响......"
这段 2008 年诺贝尔化学奖颁奖词的引文再次说明了荧光蛋白对当前生命科学的巨大影响,同时也引起了我们对未来应用的好奇。荧光蛋白(可光激活、可光开关或可光电转换的荧光蛋白)的最新发展以及超分辨率显微镜等新光学设备的建立都清楚地表明, 荧光技术的发展仍在进行之中,离终结还很遥远。
参考文献
- Pliny JB and Riley HT: The natural history of Pliny, Book XXXII. Remedies derived from aquatic animals. Chapter 52 – Other aquatic productions. Adarca or Calamochnos: three remedies. Reeds: eight remedies. The ink of the sæpia. Gaius Plinius Secundus (Pliny the Elder). AD77. Bohn HG, London (1855).
- Shimomura O, Johnson FH and Saiga Y: J Cell Comp Physiol 59 (1962) 223–239.
- Prasher DC, Eckenrode VK, Ward WW, Prendergast FG and Cormier MJ: Gene 111 (1992) 229–233.
- Chalfie M, Tu Y, Euskirchen G, Ward WW and Prasher DC: Science 263 (1994) 802–805.
- Heim R, Prasher DC, Tsien RY: Wavelength mutations and posttranslational autoxidation of green fluorescent protein. Proc Natl Acad Sci USA 91 (1994) 12501–04.
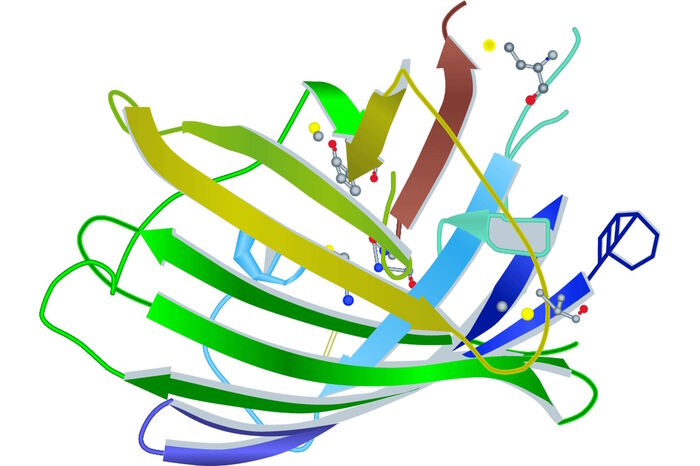
- Ormo M, Cubitt AB, Kallio K, Gross LA, Tsien RY, Remington SJ: Crystal structure of the Aequorea victoria green fluorescent protein. Science 273 (1996) 1392–95.
- Matz MV, Fradkov AF, Labas YA, Savitisky AP, Zaraisky AG, Markelov ML, Lukyanov SA: Fluorescent proteins from nonbioluminescent Anthozoa species. Nature Biotech 17 (1999) 969–73.