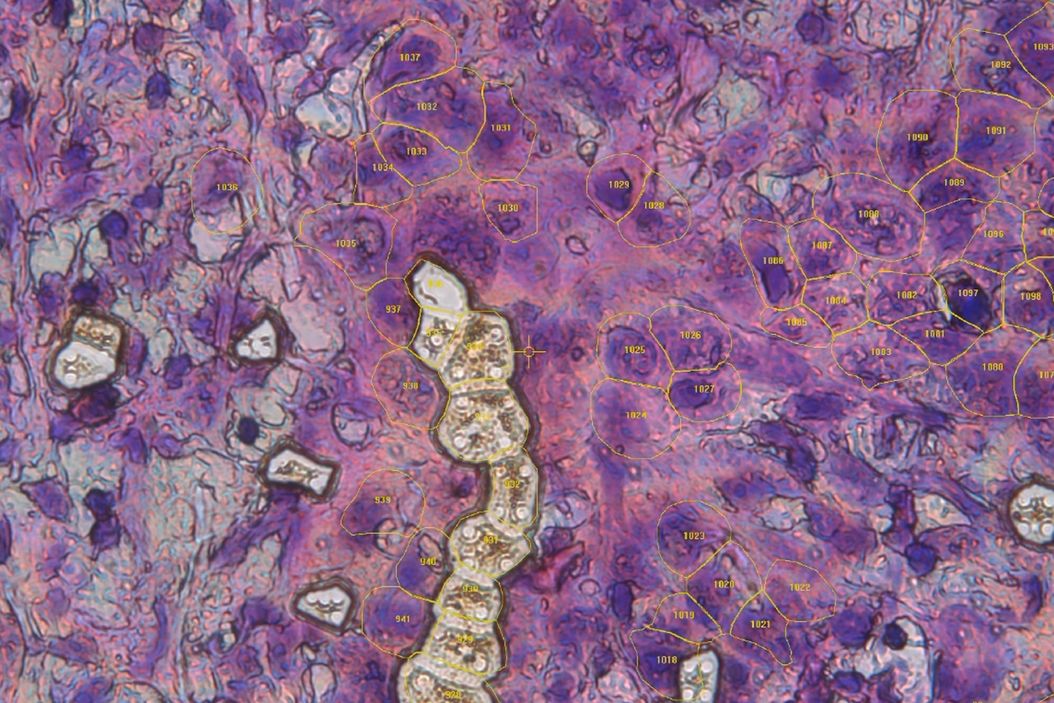
疾病进展的早期检测和分子分型仍然是现代医学面临的主要挑战。尽管基因组学和转录组学取得了进展,但组织病变的空间蛋白质组图谱在很大程度上仍未得到探索。这种方法为了解疾病进展的分子状况提供了前所未有的洞察力,为发现新型生物标记物和治疗靶点提供了支持。
其中一个亮点是应用于中毒性表皮坏死(TEN)的分子机制,这是一种危及生命的皮肤反应。DVP 发现 STAT1 是关键的驱动因素,因此成功使用了 JAK 抑制剂--8 名患者中有 8 人痊愈 [1]。
另一个例子是低级别浆液性卵巢癌。通过将 DVP 与空间转录组学相结合,确定了两个靶蛋白(FOLR1 和 CDK2A),目前已有针对这两个蛋白的临床批准抗体。小鼠模型显示肿瘤负担明显减轻。
最后,Mund 博士展示了 DVP 在胰腺癌研究中的应用。人工智能引导的图像分析确定了早期前体病变,然后对其进行了蛋白质组学鉴定。这为早期检测和靶向治疗的开发提供了新的可能性。
本网络研讨会是旨在推进早期疾病检测、解码细胞机制以及利用人工智能驱动的空间蛋白质组学在病理学和个性化医疗方面获得突破性见解的研究人员的必看内容。