简介
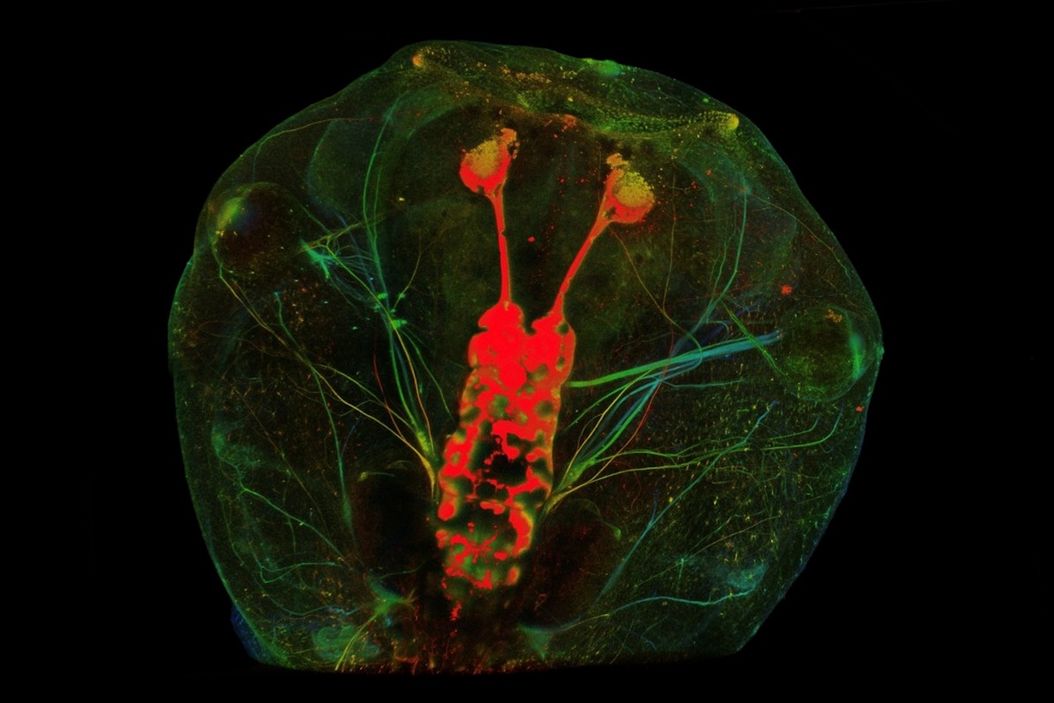
视神经是视网膜和大脑之间的联系纽带,由视网膜神经节细胞(RGC)轴突组成。这些轴突的跨度相对较大,其功能是维持视觉过程。在人类等哺乳动物中,视神经在受伤后的自我修复能力非常有限,往往会导致视力完全丧失。要改善这些患者的治疗效果,我们首先需要充分了解自然中物种再生所采用的机制。在青蛙身上,视神经受损后会自发地完全再生并恢复视力。这为我们提供了一个理想的模型系统,以了解成功的视神经再生所涉及的基本机制,并为最终在再生能力不足的物种中使用视力保护疗法确定目标途径。
视神经人工损伤模型面临的挑战
使用解剖显微镜手动操作蝌蚪视神经需要高超的显微外科技术,而且动物体型小且易碎,这对手术操作提出了挑战。即使使用微型机械手和精细镊子,人工横切也是一种侵入性操作,很难在不同操作者之间实现标准化,而且往往会导致很高的死亡率。病灶大小和位置可能会有很大差异,从而导致实验重复的不一致性。这些技术限制影响了模型的可重复性,降低了下游分析的统计能力。因此,特别是在需要精确控制视神经损伤的空间或时间的研究中,很难得出可靠的结论。
治疗视神经损伤的新型激光显微切割法
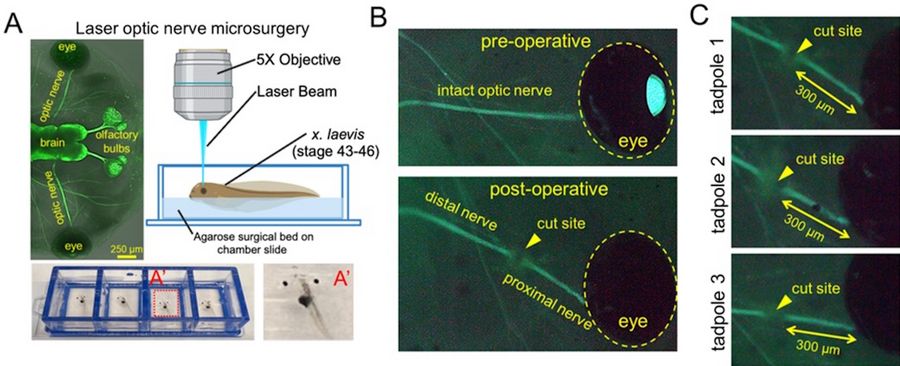
为了开发一种新的手术模型,LMD7与Xla.Tg(tubb2b:mapt-GFP)Amaya 转基因 X. laevis品系一起用于可视化和进行视神经横断及随后的轴突再生。蝌蚪 的发育阶段为 43-46 期。在这些阶段,蝌蚪是透明的,可用于实时荧光成像。简言之,蝌蚪被麻醉后,被放置在由 4% 琼脂糖制成的特制手术床上,手术床位于腔室载玻片内。蝌蚪的朝向是背朝上平放。使用 Leica LMD7 软件中的 "测量 "工具,在放大 5 倍的情况下,用 349 nm 紫外激光切割器在视神经从球状体出口的远端约 300 μm 处横切每只蝌蚪的左侧视神经。用 "绘制 "工具在视神经上绘制的线接受四次激光脉冲(120 µJ/脉冲),激光功率为 55 mW(脉冲频率 = 2710),采用激光螺旋模式(步数 = 2,步长 = 5 μm,重复次数 = 2),以切割到适当深度并横切神经。荧光视神经显像中的缺口确认了切割。然后立即取出蝌蚪,在 1X MMR 培养基中复原,并用于随后的下游实验。
结果
这种激光显微切割方法可实现高通量、可重复和微创的视神经横切,从而在损伤后短时间内实现强大的视网膜神经节细胞(RGC)轴突再生。利用 LMD7 的精确性,可确保不同生物复制中病变位置的一致性,这对下游分析至关重要。该模型已被应用于通过纵向共焦成像研究轴突动态、绘制结构变性和再生(约14天)的时间表、研究细胞死亡和增殖、评估视觉通路恢复,以及通过RNA-seq描述早期转录组反应的特征。此外,该方案还与其他转基因蝌蚪品系兼容,如表达基因编码传感器的蝌蚪品系。例如,Xla.Tg (tubb2b:GCaMP6s)NXR 株系被用来观察激光损伤开始时视神经中的钙动态。