病毒-膜相互作用
冷冻TEM的一项成熟应用就是对分离的大分子、病毒颗粒或细丝进行三维重建。一方面,这些方法基于重复结构的平均化,通过大量相同的分子、细丝上的重复图案或对称来性减少冷冻TEM固有的干扰。另一方面,三维重建所需的这些复合体的不同视图可以从(理想情况下)冰中颗粒的随机方向或细丝的螺旋性获得
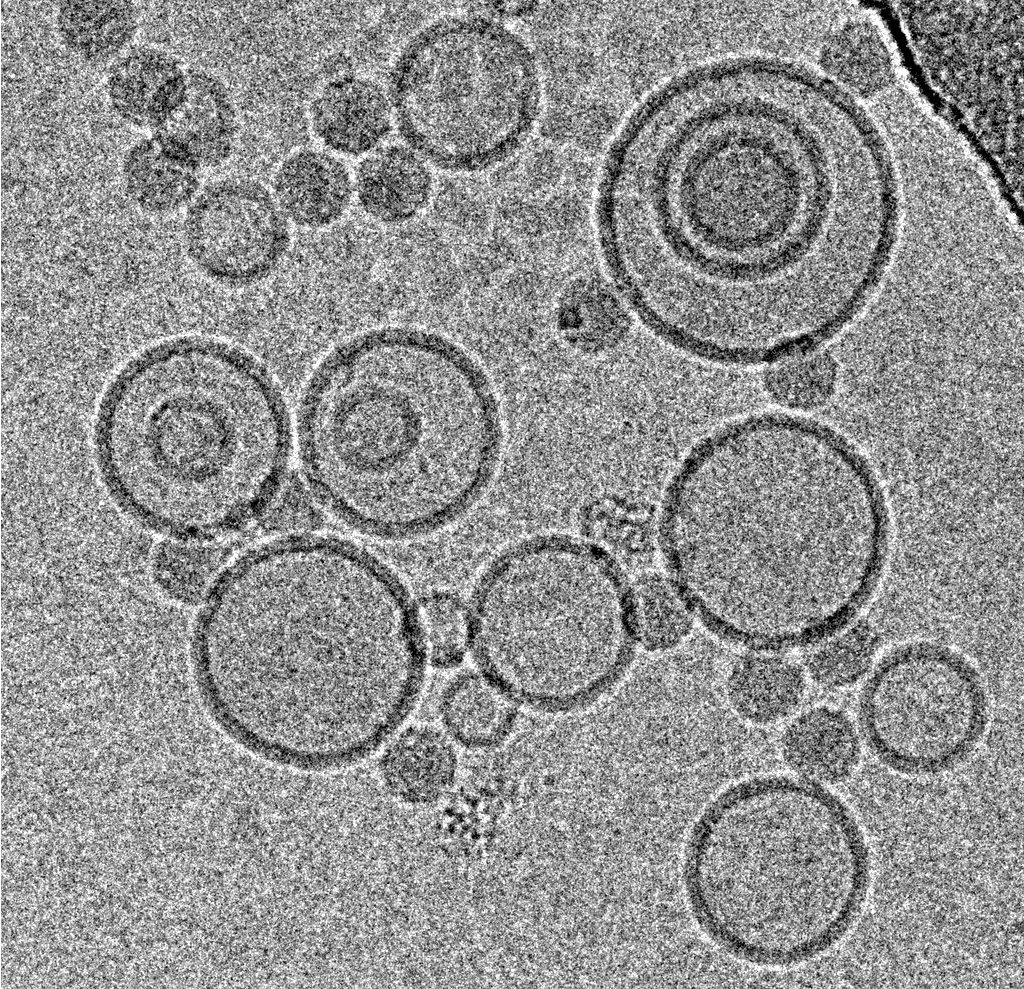
来自Max F. Perutz实验室(维也纳)Dieter Blaas小组的Mohit Kumar对于鼻病毒颗粒和脂膜的相互作用以及产生颗粒内吞作用的事件很感兴趣[1]。他们决定采用单颗粒重建方法来获得颗粒与人工膜(脂质体)对接的三维模型,并使用从许多显微照片中选出的众多单个病毒体/膜复合体。
为收集这类实验所需的大量显微照片,或冷冻大量相似的标本,结果的可重复性是一大关键因素,在这种情况下就是冰的厚度以及最低限度污染。徕卡EM GP用独特的传感器解决了潮湿、弯曲滤纸或弯曲网格导致的吸液强度问题:传感器能检测到滤纸和样本液滴接触的瞬间并建立参考点。将滤纸从参考点向前移动预定的距离,各网格之间的压力变化极小,如果使用相同的标本、体积和时间,就能得到高度可重复的结果。
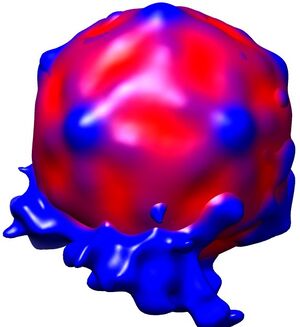
使用这种吸液传感器,可以非常有效地从4µl样品中获得结果,只要该样品涂抹在采用辉光放电处理后的 400目的Quantifoil R1.2/1.3 Cu载网支持膜,并允许在99%湿度和30°C的环境室下扩散25秒。随后,将吸液0.8秒并投入到液态乙烷中。从利用300 kV冷冻TEM在这些冷冻和未染色标本上采集的显微照片中挑选出与类似直径的脂质体结合的颗粒(图1)。从这些选定的颗粒中,作者计算了在没有细胞受体的情况下病毒/膜组件的重建,模拟了脂质膜在二十面体对称二重轴上的紧密接触,说明了病毒-膜紧密复合体的结合机制(图 2)。
杆状病毒肌动蛋白彗尾
维也纳分子生物技术研究所J. Victor Small实验室的Jan Mueller及其同事[2]使用冷冻电子断层扫描技术对于杆状病毒“彗尾”中的肌动蛋白细胞骨架进行体内和体外研究。这些肌动蛋白尾巴被杆状病毒和其他病原体核化,以驱动自身的推进力,这对传播感染至关重要。
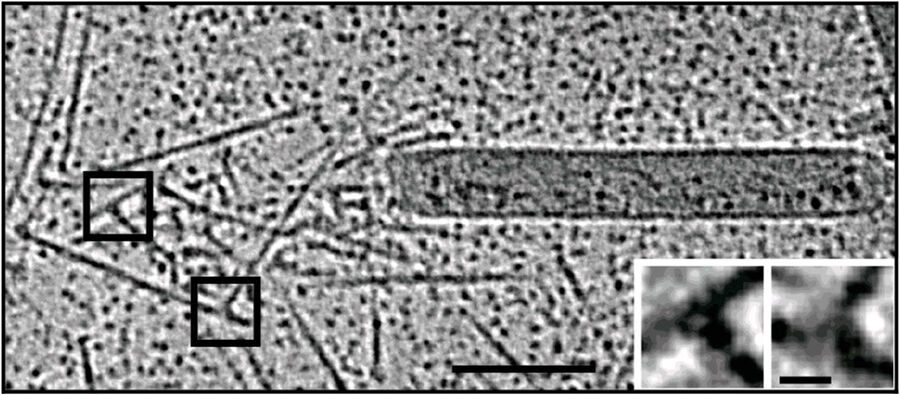
对于由合成(且易于操作)“运动性混合物”聚合的肌动蛋白尾部进行的体外实验,请勿在冷冻前将尾部移液到载网上,以防止操作造成损坏。恰恰相反,它们直接在200目Au网格上的Quantifoil R3.5/1穿孔碳膜上“生长”。在用10纳米蛋白质涂层胶体金作为电子断层扫描对齐的基准标记补充样品后,将其转移到EM GP的加湿室。将样品从背面吸液1.2至1.6秒,随后通过投入略高于冰点的液态乙烷中冷冻,并保存在液氮下直至装入显微镜。为了减少背景,使用SerialEM以300 kV在穿孔碳膜的网孔上采集零损耗过滤倾斜系列,并使用IMOD离线重建(图3)。
对于该研究的另一部分,Mueller和他的同事在活细胞的稀薄扩散部分内观察到杆状病毒的肌动蛋白彗尾,该部分可通过冷冻电子显微镜显微观察。由于引入了冷冻电子断层扫描技术以及三维解析叠加结构的能力,对该区域的研究得到了极大的推进[3]。
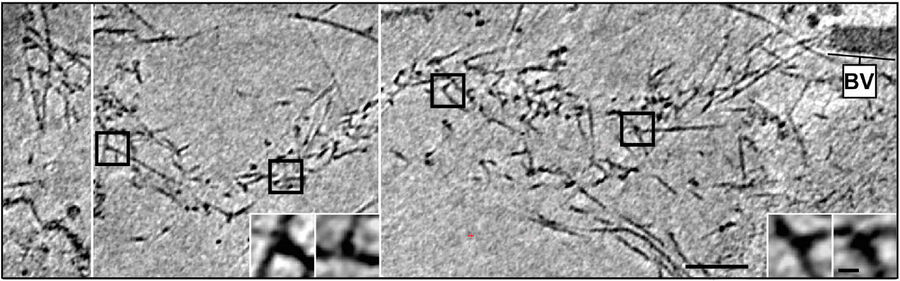
对于这些体内实验,细胞在200目Au载网上培养,以消除铜离子的细胞毒性作用和电子断层扫描中高倾斜度网格条的阻塞。使用多孔碳支持膜,例如Quantifoil R1/4。一旦细胞附着并扩散,它们就会被化学固定并提取以清除细胞溶质背景,从而能够可靠地跟踪单个细丝。随后,用4µl补充有10nm蛋白质饱和金颗粒的培养基覆盖样品,并转移到95%相对湿度的EM GP环境室中。这些样品从徕卡EM GP上的吸液器设计大大获益:由于单侧吸液,多余液体仅从网格背面吸走,避免敏感细胞单层和滤纸之间的直接接触。使用预加湿Whatman 1号滤纸进行1.5至2.0秒的吸液可产生最佳效果,并使用C膜上的孔来获得整个网格的均匀冰层厚度。吸液后,立刻将样品浸入液态乙烷中。按照上述要求获取并处理断层扫描数据(图4)。
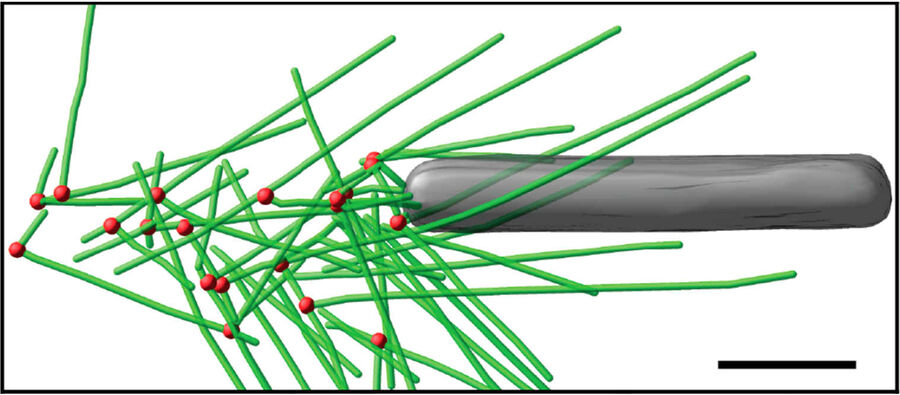
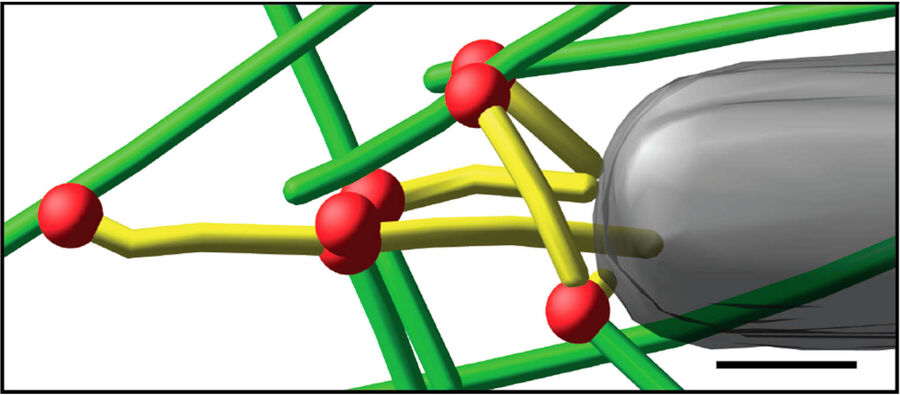
图3:杆状病毒肌动蛋白彗尾的体外冷冻电子断层扫描。 a) 含有肌动蛋白、Arp2/3复合体、凝溶胶蛋白、丝切蛋白和VASP的运动性混合物中,在去包膜的纯化杆状病毒上形成的彗尾的体外冷冻电子断层扫描切片(11nm)。插图显示了概览图像中正方形的分支连接点的详细信息。b) 来自断层扫描的模型,绿色表示肌动蛋白细丝,红色表示分支连接点。 c) 模型特写,突出显示与病毒后部相邻的黄色细丝。网格条(a, b),100nm;c) 25nm;插图,10nm(Mueller J et al.:杆状病毒肌动蛋白彗尾的电子断层扫描和模拟支持病原体推进的栓系细丝模型。PLoS Biol.12 [1]: e1001765, Figures a–c; doi: 10.1371/journal.pbio.1001765.g005).
图4:体内杆状病毒肌动蛋白彗尾的冷冻电子断层扫描。a) B16 黑色素瘤细胞中杆状病毒彗尾的冷冻电子断层照片。图像显示了断层照片的19nm部分。由于病毒尾部与冰层不在一个平面,因此断层照片显示为三个图像,由白线分隔,在不同的z水平上拍摄。插图显示了概览图像中正方形分支连接点的详细信息。 b) 完整彗尾模型后部的投影,宿主细胞骨架(半透明)的肌动蛋白细丝以及一条微管(灰管)叠加。网格条 a),100nm(Mueller J et al.: 杆状病毒肌动蛋白彗尾的电子断层扫描和模拟支持病原体推进的栓系细丝模型。PLoS Biol.12 [1]: Figures 3a + d; doi: 10.1371/journal.pbio.1001765.g003).
药物纳米载体
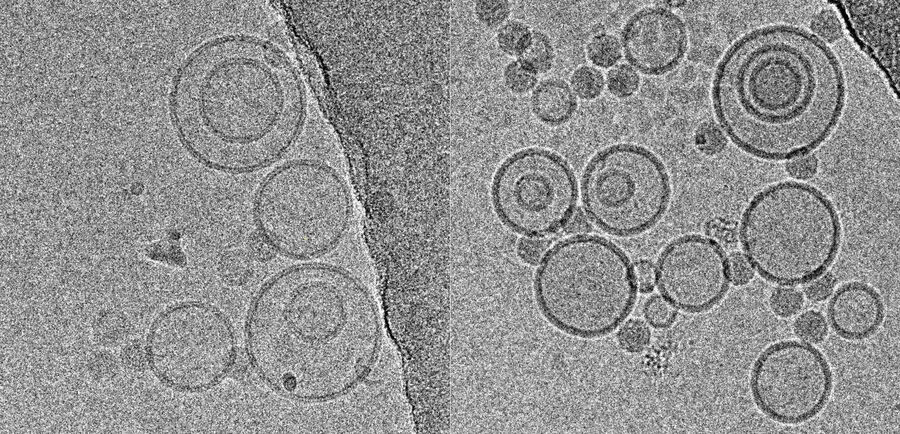
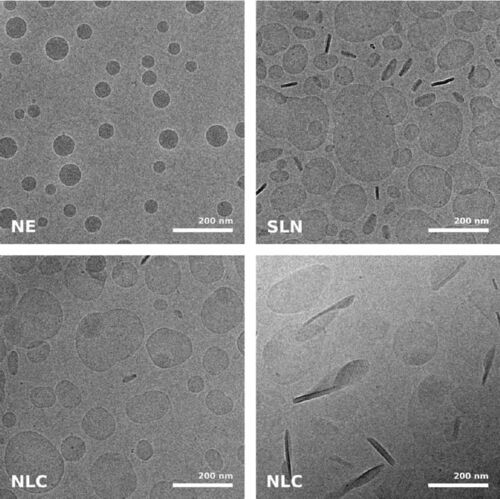
沉浸式冻结和冷冻TEM不仅是结构和细胞生物学中不可或缺的工具,而且对于在自然状态下对药理学样本进行成像也非常有用(有关评论,参见[4])。一项研究[5]使用沉浸冷冻标本的冷冻TEM来阐明用于皮肤给药的不同超声工程纳米载体的超微结构:可以看到固体脂质纳米颗粒、纳米结构脂质载体,和纳米乳液。
这些实验的样品使用徕卡EM GP冷冻,仪器在室温和95%rH的环境室中运行。从一系列预测试中获得每个标本在双蒸水中的最佳稀释度,以产生密度良好的标本,确保各个结构之间没有太多重叠。将4µl标本覆盖到涂有穿孔碳膜的辉光放电处理后的400目EM载网上。经过沉降后,根据使用的配方,对悬浮液吸液1.25-4.0秒。使用标准Whatman 1号滤纸和仪器的吸液传感器,吸液后立即将样品投入态乙烷中。
虽然来自冷冻TEM的尺寸信息与从动态光散射获得的数据互补,但结构信息是冷冻TEM独有的数据,并且各个标本之间呈现出的巨大差异,包括从球形液滴到扁平的片状结构(图5)。请注意此处显示的显微照片中没有污染,这是因为GP中集成了快速处理和一些防污染措施:这包括负压环境和初级冷冻剂中强大的“TF”蒸发器,它会产生干燥的低温氮气环境,以保护标本免受升温和污染。
推荐阅读
- Resch GP, Brandstetter M, Königsmaier L, Urban E, and Pickl-Herk AM: Immersion freezing of suspended particles and cells for cryo-electron microscopy. Cold Spring Harb. Protoc. 803–14 (2011).
- Resch GP, Brandstetter M, Wonesch VI, and Urban E: Immersion freezing of cell monolayers for cryo-electron tomography. Cold Spring Harb. Protoc. 815–23 (2011).
References
- Kumar M, and Blaas D: Human rhinovirus subviral a particle binds to lipid membranes over a twofold axis of icosahedral symmetry. J. Virol. 87: 11309–12 (2013).
- Mueller J et al.: Electron tomography and simulation of baculovirus actin comet tails support a tethered filament model of pathogen propulsion. PLoS Biol. 12: e1001765 (2014).
- Medalia O et al.: Macromolecular architecture in eukaryotic cells visualized by cryoelectron tomography. Science 298: 1209–13 (2002).
- Klang V, Valenta C, and Matsko NB: Electron microscopy of pharmaceutical systems. Micron 44: 45–74 (2013).
- Schwarz JC et al.: Nanocarriers for dermal drug delivery: influence of preparation method, carrier type and rheological properties. Int. J. Pharm. 437: 83–88 (2012).

![[Translate to chinese:] Multicolor TauSTED Xtend 775 for Cell Biology applications that require nanoscopy resolution for multiple cellular components. Cells showing vimentin fibrils (AF 594), actin network (ATTO 647N), and nuclear pore basket (CF 680R). [Translate to chinese:] Multicolor TauSTED Xtend 775 for Cell Biology applications that require nanoscopy resolution for multiple cellular components. Cells showing vimentin fibrils (AF 594), actin network (ATTO 647N), and nuclear pore basket (CF 680R). Sample courtesy of Brigitte Bergner, Mariano Gonzales Pisfil, Steffen Dietzel, Core Facility Bioimaging, Biomedical Center, Ludwig-Maximilians-University, Munich, Germany.](/fileadmin/_processed_/5/4/csm_Triple_color_fixed_sample_TauSTED_Xtend_2_3_c7d82e8a27.jpg)
![[Translate to chinese:] Preparation of an IC-chip cross section: grinding and polishing of the chip cross section. [Translate to chinese:] Preparation of an IC-chip cross section: grinding and polishing of the chip cross section.](/fileadmin/_processed_/3/b/csm_Grinding_polishing_EM_TXP_fa72ea5feb.jpg)
![[Translate to chinese:] Water Flea Daphnia imaged by Electron Microscopy. Courtesy of Mag. Dr. Gruber, University of Vienna, Austria. [Translate to chinese:] Water Flea Daphnia imaged by Electron Microscopy. Courtesy of Mag. Dr. Gruber, University of Vienna, Austria](/fileadmin/_processed_/e/d/csm_EM_Application_Water_Flea_Daphnia_0d1b51542d.jpg)