光激活蛋白
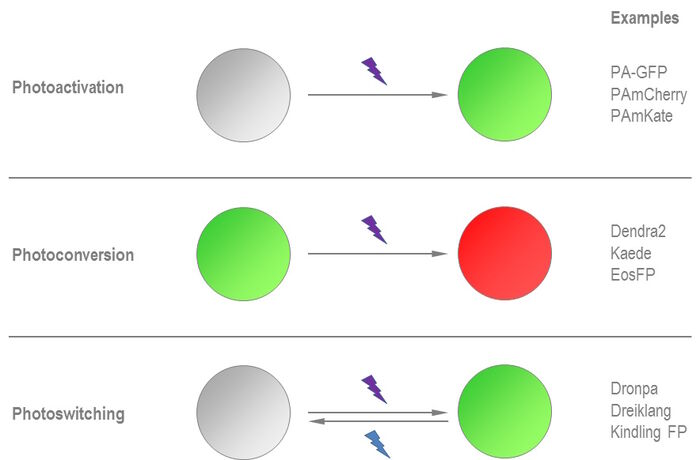
光激活蛋白可以从低荧光状态“切换开启”成更高的荧光状态。在紫/蓝光谱中使用短光脉冲后,开关切换就会在不到1秒时间内出现并可用于检测动态细胞过程。感兴趣区域(ROI)中分子的定向光激活可用于监测这些活化蛋白在细胞内的运动。但在其他的脉冲追踪实验装置如FRAP当中,人们无法区分重新进入ROI的蛋白质和新合成的分子,光激活是规避这个问题的方法之一。
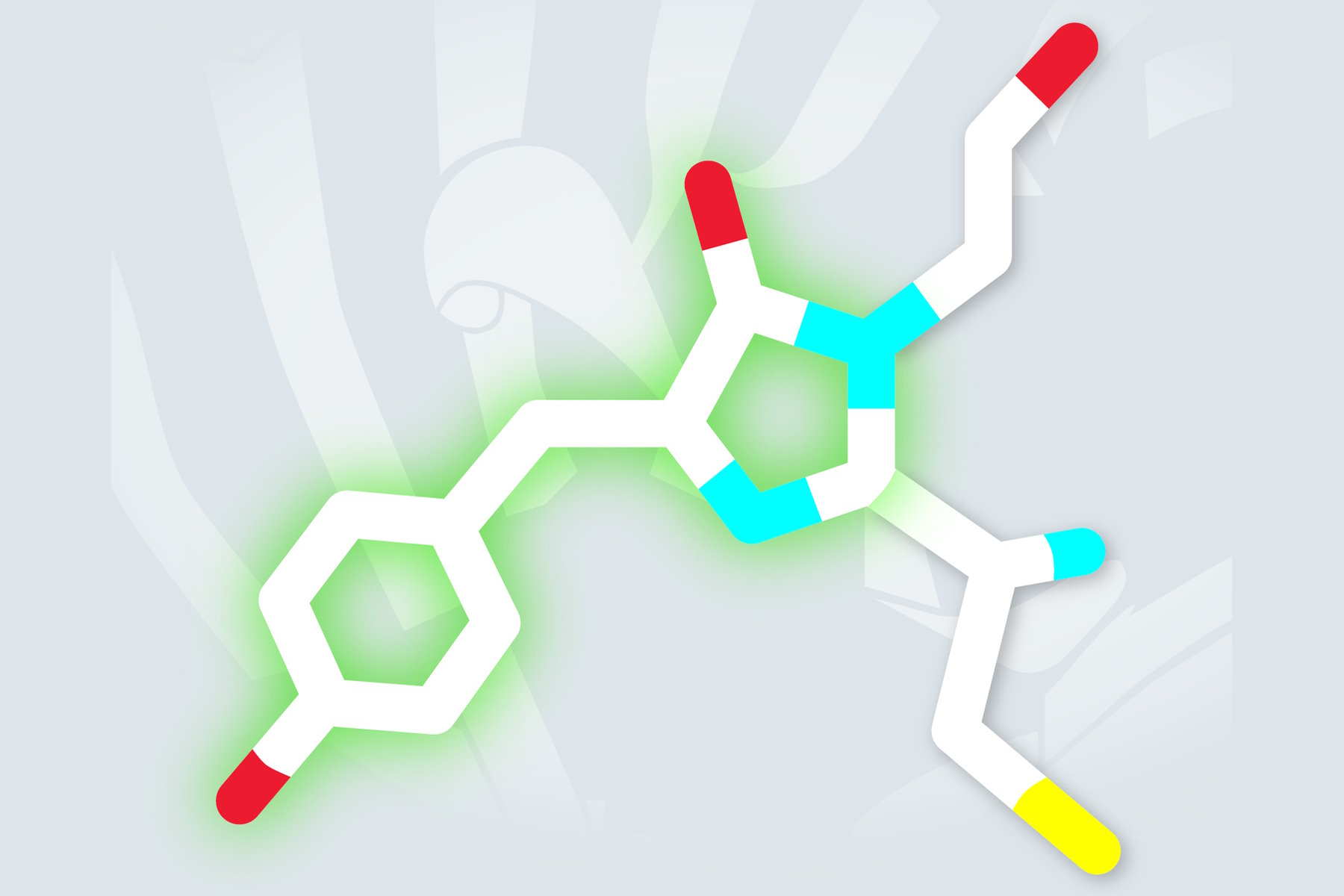
第一个光激活蛋白是wtGFP变体,由Lippincott-Schwarz和Patterson创造。该蛋白含有一处单点突变(T203H),导致在450到550 nm范围内的吸光度非常低。PA-GFP(光激活绿色荧光蛋白)在紫光帮助下获得光激活,将其吸收最大值从400 nm切换到504 nm(见图2)。因此,当用488nm的波长激发时,其荧光增加约100倍,活化和未活化蛋白之间的强烈对比可以反映这种现象[1]。
PA-GFP活化的基本过程似乎是残基222中谷氨酸侧链的光诱导脱羧。脱羧改变了生色团的结构,从中性到阴离子状态[2]。
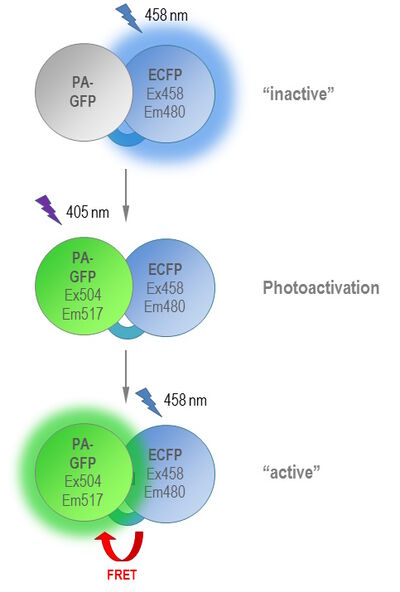
此处应提及的另一候选蛋白为Phamret(光激活介导共振能量传递),一种通过FRET进行光激活的特殊串联二聚体荧光蛋白。Phamret是一种融合蛋白,由一个PA-GFP与其FRET荧光对ECFP共价偶联而成。458nm波长下曝光会导致480nm处发射ECFP。PA-GFP的相邻光激活通过405nm激光束进行。之后在458nm下重复曝光导致出现了激发ECFP和PA-GFP之间的FRET并形成绿色荧光。因此,“未活化”和“活化”形式可以被相同的激光波长激发(如图3所示)。缺点可能是由两个荧光蛋白组成的蛋白质的大小,可能引起空间问题。
光转化蛋白
不同于光激活蛋白,光转化蛋白在未转变状态下就已经发出荧光。因此该蛋白可以更容易地界定的ROI。光转化作用在石化片脑纹珊瑚(大花脑珊瑚)当中发现。鉴于这种蛋白的发射特性,在UV(紫外线)光照的光转化后会从绿色变成红色,因此这种荧光蛋白又被叫做Kaede,就像枫叶一样[4]。这些树叶在秋天会从绿色变成红色。如果Kaede在 380到400 nm之间的波长内进行光转化,其发射最大值会从518 nm变为582 nm。红绿色荧光之间巨大的比值变化可以体现这一点,其中的系数高达2,000。这种转变不可逆(见图4)。另一个限制因素是Kaede的四聚体性质,这使得它很难用于活细胞成像研究。FP的寡聚可能导致人们误判标记的感兴趣蛋白(POI)的位置。聚合甚至可以完全抑制POI的正确功能。
光转化过程的基础是光诱导过程。在这种情况下,生色团(His61-Tyr63-Gly64)内的组氨酸残基通过辐射被裂解,并最终导致形成高度共轭的双咪唑环结构。这一过程与荧光向红色波长的转移有关[2]。
红绿色转变FP来自珊瑚属Dendronephtytha sp。该蛋白的名称和红色活化属性反映在表达式Dendra [5]中。Dendra2的商业开发就成为了首个单体红绿色光转化蛋白。
另一种广泛使用的荧光蛋白是tdEosFP [6, 8],主要从石珊瑚(Labophyllia hemprichii)当中分离获得。串联二聚体在近紫外照射后可以从绿色荧光转化为红色荧光,基本都会用于超分辨率显微镜,单体版本 mEos和mEos2也是如此。
在第三种石珊瑚Favia favus中发现了一种与Keade特征非常相似的光转化蛋白。近紫外照射后,四聚体KikGR的荧光由绿色变为红色,但都比Kaede亮得多。它的商业变体被称为Kikume,可以通过750nm波长的多光子激发进行光转换。像这样的蛋白可以用于厚组织标本。KikGR的突变导致单体形式mKikGR。与mEos2和Dendra2一起,这种蛋白成了超分辨率成像常用的荧光蛋白。
光控开关蛋白
光激活是从非荧光状态到荧光状态的不可逆转换,而光开关蛋白能够在这两种状态之间穿梭[7]。在不同波长光脉冲的帮助下,这些荧光蛋白可以开关几百次而不发生光漂白。这种在荧光态和暗态之间切换的现象称为光致变色,并且已经在wtGFP的单分子水平上出现,尽管程度很低。
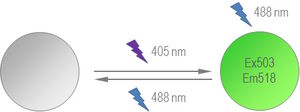
用于超分辨率显微镜成像的一种比较知名的光控开关蛋白衍生自石珊瑚,Dronpa,一种单体,由于其阴离子脱质体生色团,在503nm处有一个吸收最大值,由于其中性质子化生色团,在390nm处有一个较小的吸收最大值(见图5)。阴离子型在518nm处发射最大,而中性型为非荧光状态。
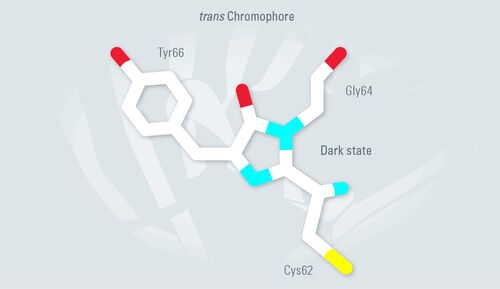
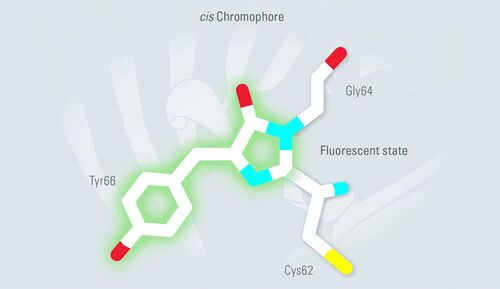
此外还有一种顺反异构化与生色团的质子化有关。在生色团中性状态下,Tyr66为反式构象(见图6)。在阴离子状态下,Tyr66具有顺式构象。当用405nm激光脉冲照射时,Dronpa被迫进入其荧光顺式构象。488nm的激光脉冲将Dronpa构象转换为非荧光反式。这个循环可以重复几百次。
四聚体式光控开关蛋白,红色区域内发射最大为Kindling FP(KFP1)。
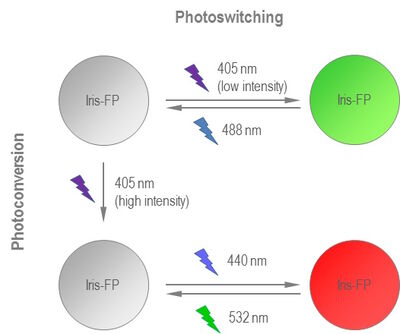
最新的研究是要打造一种新型光学荧光灯,可以将光转换和光控开关结合起来。IrisFP是一种wtEosFP衍生物,在其绿色荧光和红色荧光构象中具有开关状态。换言之,在用高强度405nm激光束照射时,IrisFP从其绿色发射状态转移到红色发射状态。绿色IrisFP可以在488nm激光的帮助下关闭。405nm的低强度激光再次开启。另一方面,红色IrisFP用532nm激光关闭,用440nm激光再次打开。单体形式mIrisFP的相邻结构为进一步的应用打开了大门[3]。
其他特殊荧光蛋白
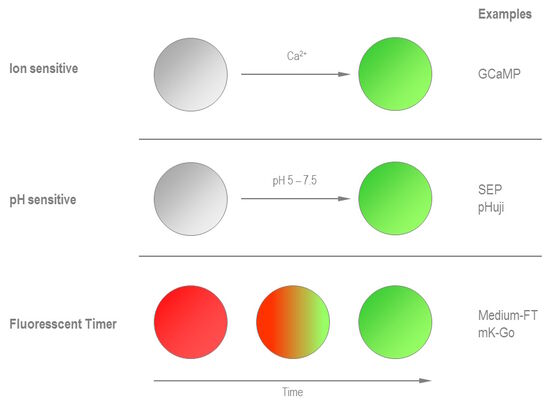
除了荧光蛋白易受光的操纵外,还有其他蛋白质可通过进一步的触发物进行转换(见图8)。例如,对活细胞离子状态感兴趣的研究人员可以选择GCaMP作为钙离子指示剂。GCaMP的荧光行为取决于其与Ca2+的结合。其他荧光蛋白如VSFP1可用于检测膜电位,而黄色荧光蛋白YFP-H148Q对氯离子敏感。此外,FPs的荧光特性随环境pH值的变化而变化。Superecliptic pHluorin(SEP)和pHuji就是两个例子。在此帮助下,胞内和胞外反应以及胞内分选可以获得追踪。
荧光蛋白随着时间改变其发射光谱称为荧光计时器。这种不是pH值变化、离子强度或蛋白质浓度的结果,而是独立于这些生化参数而发生的。换句话说,相关蛋白质的年龄可以通过其颜色来估计。有了这些特性,就有可能测量活细胞内的时间和依赖时间的事件。
第一个荧光计时器是由Sergey A. Lukyanov 实验室在2000年报道。这种被命名为FT(荧光计时器)的DsRed突变体在18小时内将其发射光谱从红色波长改变为绿色波长。由于FT是四聚体,Vladislav Verkhusha认为有必要创建单体的荧光计时器。Mchery的突变导致3个以上的荧光计时器具有不同的转化时间(见表1)。这些蛋白质在快、中、慢的时间尺度上从蓝色变为红色,但仍然太慢,无法测量几分钟内发生的细胞过程。
尽管如此,在荧光计时器的帮助下我们依然可以通过空间和时间分辨率来观察活细胞内的蛋白质活动。此外,蛋白质转运或病毒组装可以跟踪或基因表达可以监测。该应用列表肯定可以扩展,而且会呈现出荧光计时器的潜在用途。
表1:选定的光激活、光转化和光控开关蛋白以及荧光计时器
蛋白 | Exmax(nm) | Emmax(nm) | QY | 亮度 | pKa | 结构 | 其他 |
光激活蛋白 |
|
|
|
|
|
| 活化条件 |
PA-GFP | 400 | 515 | 0.13 | 2.7 | 单体 | violet | |
PAmCherry | 404 564 | ND 595 | ND 0.46 |
8 |
6.3 | 单体 | 350 – 400 nm |
PATagRFP | ND 562 | ND 595 | ND 0.38 | ND 25.1 | ND 5.3 | 单体 | 紫色 |
PAmKate | ND 586 | ND 628 | ND 0.18 | ND 4.5 | ND 5.6 |
| 405 nm |
Phamret (PA-GFP + ECFP) | 458 | 475 | 0.40 | 13 |
| 单体 | 紫色 |
光转化蛋白 |
|
|
|
|
|
| 转化条件 |
mClavGR2 | 488 566 | 504 583 | 0.77 0.53 | 14.6 17 | 8 7.3 | 单体 | 405 nm |
mMaple | 489 566 | 505 583 | 0.74 0.56 | 11.1 16.8 | 8.2 7.3 | 单体 | 380 nm |
Dendra2 | 490 | 507 | 0.50 | 22 | 6.6 | 单体 | 初始状态紫色 |
PS-CFP2 | 400 490 | 468 511 | 0.2 0.23 | 8.6 10.8 |
| 单体 | 紫色 |
Meos3.2 | 507 572 | 516 580 | 0.7 0.55 | 53 18 | 5.4 5.8 | 单体 | 405 nm |
Kaede | 508 | 518 | 0.88 | 87 | 5.6 5.6 | 四聚体 | 初始状态紫色 |
EosFP | 506 571 | 516 581 | 0.7 0.55 |
|
| 四聚体 |
|
mEosFP | 505 569 | 516 581 | 0.64 0.62 |
|
| 单体 |
|
mEos2 | 506 | 519 | 0.84 | 47 | 5.6 | 单体 | 初始状态紫色 |
kikGR (Kikume) | 507 583 | 517 593 | 0.7 0.65 | 37.6 22.8 | 7.8 5.5 | 四聚体 | 365 nm |
PSmOrange | 548 636 | 565 662 | 0.51 0.28 | 58 9 | 6.2 5.6 | 单体 | 蓝绿 |
PSmOrange2 | 546 619 | 561 651 | 0.61 0.38 | 31.1 7.2 | 6.6 5.4 | 单体 | 489 nm |
mKikGR | 505 | 515 | 0.69 | 34 | ND | 单体 | 初始状态紫色 |
光控开关蛋白 |
|
|
|
|
|
| 活化/淬火条件 |
mTFP0.7 | 453 | 488 | 0.5 |
|
| 单体 | 405 nm / 458 nm |
PDM1-4 | 503 | 517 |
|
|
|
| 405 nm / 488 nm |
Dronpa | 503 | 518 | 0.85 | 80.8 | 5.0 | 单体 | 紫色/蓝色 |
Dronpa-2 | 489 | 515 | 0.28 |
|
| 单体 | 405 nm / 488 nm |
Dronpa-3 | 489 | 515 | 0.33 |
|
| 单体 | 405 nm / 488 nm |
bsDronpa | 460 | 504 | 0.5 |
|
| 单体 | 405 nm / 488 nm |
Padron | 503 | 522 | 0.64 |
|
| 单体 | 503 nm / 405 nm |
Padron0.9 | 500 | 524 |
|
|
|
| 500 nm / 400 nm |
Mut2Q | 496 | 507 | 0.28 |
|
| 单体 | 405 nm / 478 nm |
rsFastLime (DronpaV157G) | 496 | 518 | 0.77 |
|
| 单体 | 405 nm / 488 nm |
rsKame (DronpaV157L) | 503 | 518 | 0.86 |
|
|
|
|
Dreiklang | 515 | 529 | 0.41 | 34 | 7.2 | 单体 | 365 nm / 405 nm |
mGeos-M | 503 | 514 | 0.85 | 43.9 | 4.5-5 | 单体 | 405 nm / 488 nm |
EYQ1 | 510 | 524 | 0.72 |
|
| 单体 | 405 nm / 514 nm |
KFP1 | 590 | 600 | 0.07 |
|
| 四聚体 | 532 nm / 458 nm |
rsCherry | 572 | 610 | 0.02 |
|
| 单体 | 550 nm / 450 nm |
rsCherryRev | 572 | 608 | 0.005 |
|
| 单体 | 450 nm / 550 nm |
rsTagRFP | 567 | 585 | 0.11 |
|
| 单体 | 445 nm / 570 nm |
mApple | 568 | 592 | 0.49 |
|
| 单体 | 480 nm / 570 nm |
asFP595 | 572 | 595 | <0.001 |
|
| 四聚体 | 569 nm / 450 nm |
Kindling FP (KFP1) | 580 | 600 | 0.07 | 4.1 | ND | 四聚体 | 绿色 / 450 nm |
rseGFP | 493 | 510 | 0.36 | 16.9 | 6.5 | 单体 | 405 nm / 488 nm |
rseGFP2 | 478 | 503 | 0.3 | 18.4 | 5.8 | 单体 | 408 nm / 478 nm |
Photoconvertible/ |
|
|
|
|
|
|
|
IrisFP | 488 | 516 | 0.43 | 22 |
| 四聚体 |
|
mIrisFP | 486 | 516 | 0.54 | 25 | 5.4 | 单体 | 紫色(黑至绿) 青色(红至黑) 紫色(绿至红) |
荧光计时器 |
|
|
|
|
|
| 过渡时间(h) |
Slow-FT | 402 | 465 | 0.35 | 12 | 2.6 | 单体 | 9.8 |
Medium-FT | 401 | 464 | 0.41 | 18 | 2.7 | 单体 | 1.2 |
Fast-FT | 403 | 466 | 0.30 | 15 | 2.8 | 单体 | 0.25 |
mK-Go | 500 | 509 | ND | ND | 6.0 | 单体 | 10 |
Exmax: 激发最大值,Emmax: 发射最大值,QY: 量子场,亮度用量子场和摩尔激发系数的乘积除以1,000来进行计算
参考文献
1. Diaspro A, Testa I, Caorsi V, Mazza D, Vicidomini G, Barozzi S, Parazzoli D, Transidico P, Garrè M and Faretta M: 4D Photoactivation of pa-GFP in Living Cells Using Two-Photon Excitation Laser Scanning Microscopy.
2. Olesya V, Stepanenko O, Stepanenko V, Shcherbakova DM, Kuznetsova IM, Turoverov KK and Verkhusha VV: Modern fluorescent proteins: from chromophore formation to novel intracellular applications. BioTechniques 51 (2011) 313–327.
3. Wu B, Piatkevich KD, Lionnet T, Singer RH and Verkhusha VV: Modern fluorescent proteins and imaging technologies to study gene expression, nuclear localization, and dynamics. CurrOpin Cell Biol 23:3 (2011) 310–317.
4. Ando R, Hama H, Yamamoto-Hino M, Mizuno H and Miyawaki A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proc Natl Acad Sci USA 99:20 (2002) 12651–6.
5. Gurskaya NG, Verkhusha VV, Shcheglov AS, Staroverov DB, Chepurnykh TV, Fradkov AF, Lukyanov S and Lukyanov KA. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nat Biotechnol 24:4 (2006) 461–5. Epub 2006 Mar 19.
6. Wiedenmann J, Ivanchenko S, Oswald F, Schmitt F, Röcker C, Salih A, Spindler KD, Nienhaus GU. EosFP, a fluorescent marker protein with UV-inducible green-to-red fluorescence conversion. Proc Natl Acad Sci USA. 101:45 (2004) 15905–10. Epub 2004 Oct 25.
7. Zhou X and Lin MZ: Photoswitchable Fluorescent Proteins: Ten Years of Colorful Chemistry and Exciting Applications. Curr Opin Chem Biol. 2013 Aug; 17(4): 682–690.
8. Jörg Wiedenmann, Sergey Ivanchenko, Franz Oswald, Florian Schmitt, Carlheinz Röcker, Anya Salih, Klaus-Dieter Spindler, and G. Ulrich Nienhaus: EosFP, a fluorescent marker protein with UV-inducible green-to-red fluorescence conversion