受激拉曼散射样品制备
- 受激拉曼散射信号需要通过透射光模式检测。因此,样品至少应具备半透明特性。
- 若实验条件允许,较厚或透明度较低的样品应切片至合适厚度。根据经验,10-100 微米厚的切片效果良好。此外,也可采用 CARS显微镜检测厚样本,该技术兼容透射光和入射光(落射照明)两种模式。
- 样本可为新鲜组织或用福尔马林固定。脂质相关分析的样本不宜用甲醛固定,因该固定方法会导致样本中脂质流失。当研究非脂质分子时,脂质成分可能影响信噪比(SNR),此时甲醇固定反而具有优势。
- 对于新鲜样本,进行长时间光谱扫描时需注意识别可能产生的运动伪影。
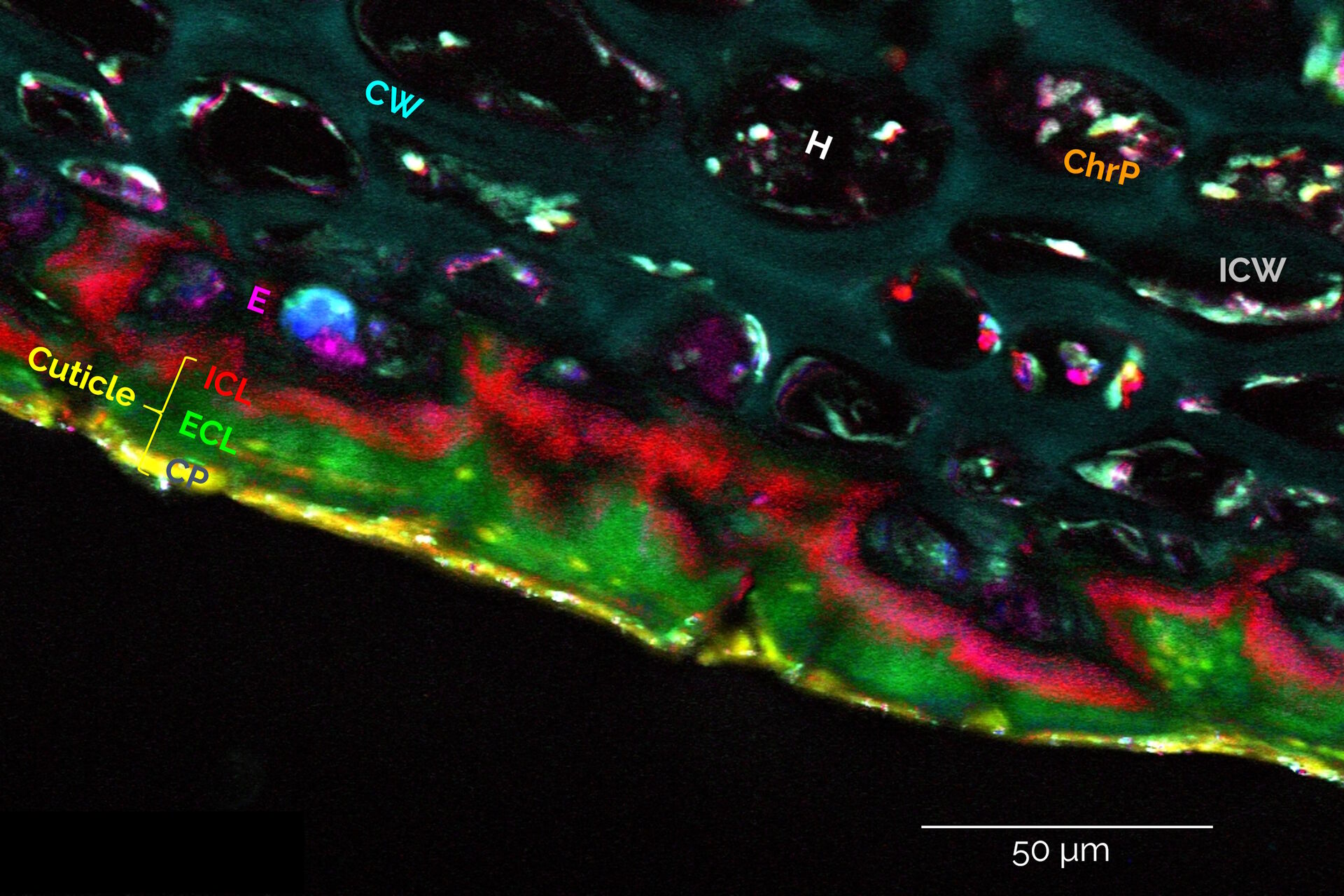
- 样本可夹在盖玻片与载玻片之间。与自发拉曼散射不同,非线性光学信号的产生能高度抑制离焦区域的信号,因此来自基底和光路中其他组件的荧光背景信号几乎不存在。此外,对基底材料也无特殊要求。在夹层结构中,样本的位置应同时位于物镜和聚光镜的工作距离内(见下文),故理想状态下样本需与盖玻片及载玻片表面直接接触。
- 推荐使用水溶液或缓冲液对样本进行封片,例如使用双面粘性垫片对样本进行夹持。必要时可采取包埋处理(常规荧光封片介质如 Mowiol 或 Dako,以及水凝胶如 Matrigel 或琼脂糖皆可使用)。石蜡包埋切片无论是否去除石蜡均可成像,但我们强烈建议先行去除。
- 也可以对置于玻璃底培养皿中的样本进行成像,例如使用配有水镜和S1油聚光镜的STELLARIS 8 CRS显微镜。
- 在许多情况下,即使是荧光标记的样本也能通过 SRS 进行检测,而不会因荧光串扰影响 SRS 通道。因此,可以实现荧光图像与 SRS 信号的相关分析。SRS 不受大多数荧光信号影响的特性源于其基于锁相放大的检测方案及显著红移的检测波段。在极少数出现荧光干扰信号的情况下,通常可通过光谱分析将其与真实的 SRS 信号区分(荧光信号的光谱依赖性较弱甚至没有,而 SRS 信号会呈现明显的光谱峰)。
SRS 成像工作流程
在CARS/SRS成像中,物镜的选择至关重要,因为泵浦/斯托克斯脉冲必须在三维空间和时间上重合以获得最佳信号强度。推荐使用的物镜包括:
- 10倍 数值孔径0.4的高对比度平场复消色差空气镜
- 20倍 数值孔径0.75 的高对比度平场红外复消色差水镜
- 25倍,适用于可见和红外光及 0.17 毫米盖玻片,数值孔径0.95的高对比度荧石水镜
- 40倍带校正环,数值孔径1.1的高对比度平场红外复消色差水镜 (注:针对每个样品优化校正环的位置可能显著影响信号强度和图像质量)
请注意,每个物镜都需要优化泵浦光和探测光脉冲的时间重合度。此项延迟校准应由徕卡服务人员执行。
在SRS显微成像中,强烈建议使用数值孔径(NA)大于激发物镜 NA的聚光镜!若未满足此条件,可能产生非SRS的杂散信号。推荐使用S1系列聚光镜(NA 0.9的空气镜或NA 1.4的油镜)。
初步检测时,建议在预期信号最强的振动频率下成像(典型生物样本通常在CH伸缩振动区,如脂质丰富的样本选2850 cm⁻¹,蛋白质丰富的样本选2935 cm⁻¹)。在此频率下调节激光功率和检测器增益以充分利用图像动态范围。典型 SRS 成像参数见表 1。
| 激光控制界面中的泵浦光/斯托克斯光功率设置 | 激光输出端功率:泵浦光150mW,斯托克斯光 300mW;保持1:2比例。泵浦光切勿超过150mW以防损坏SRS检测器! |
| 强度调节滑块 | 20-40% |
| SRS检测器增益 | 约为满量程的10%。仅在激光功率已调至最大时方可增加。 |
表 1:受激拉曼散射显微镜典型采集参数
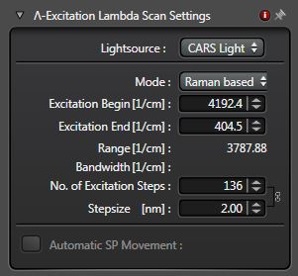
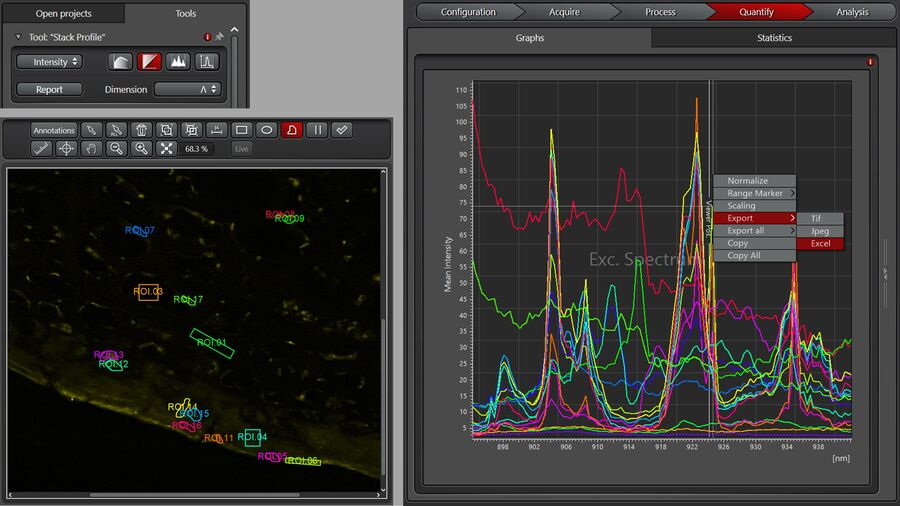
在图 1 所示的 Lambda 扫描窗口中,选择扫描的起始点、结束点及步进。建议将光谱扫描分为两个区域:高波数区(HWR,~3100 cm⁻¹至~2800 cm⁻¹)和指纹区(FPR,~1800 cm⁻¹至~600 cm⁻¹),因这两个区域的信号强度与光谱复杂度存在差异。
典型的HWR扫描通常包含30-40个光谱点,步进为 0.5nm,可一次性完成采集。
对于FPR的扫描,为了充分采集更窄的光谱特征,建议采用0.4 nm的较小步进。整个指纹区的扫描可能包含200-300个光谱点,应将其分解为多个部分进行扫描。此步骤是为了在调节激光参数时保持其最佳稳定性。每个扫描部分可手动设置,也可在Live Data Mode中设置为 xyΛ序列。后续可通过处理工具将分段扫描获得的独立图像序列合并,并进行联合分析。
生物样本中的 FPR 信号强度通常比 HWR 信号弱5-10倍。这通常需要增加激光功率(通常比HWR扫描高约50%)、提高SRS检测器增益(通常比FPR扫描高2-3倍),且根据所需信噪比(SNR),可能还需通过行/帧平均或信号累加等方式进一步强化信号。
由于FPR光谱可能相当复杂,需特别注意确保样本中任何感兴趣结构的信号在任何光谱点都不会饱和。若已知最强信号的振动频率,应针对这些频率优化FPR扫描的采集设置;若未知,则典型的候选频率是在约1445 cm⁻¹处的总脂质信号,或在某些情况下在约1655 cm⁻¹处的不饱和脂质信号。
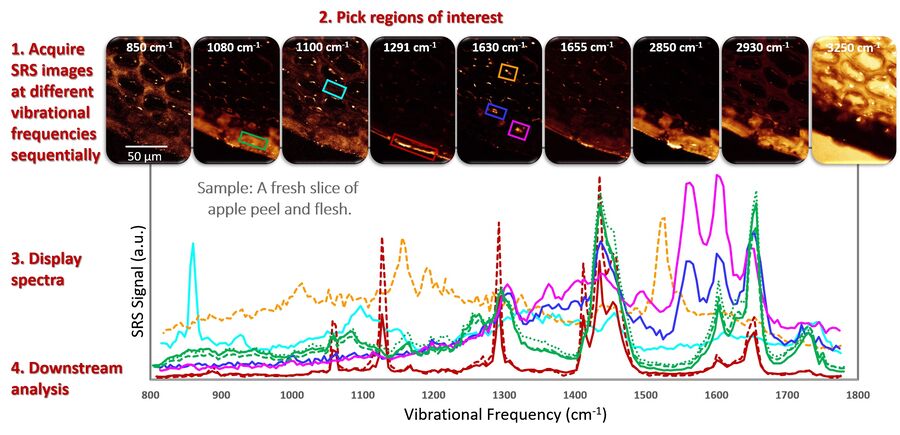
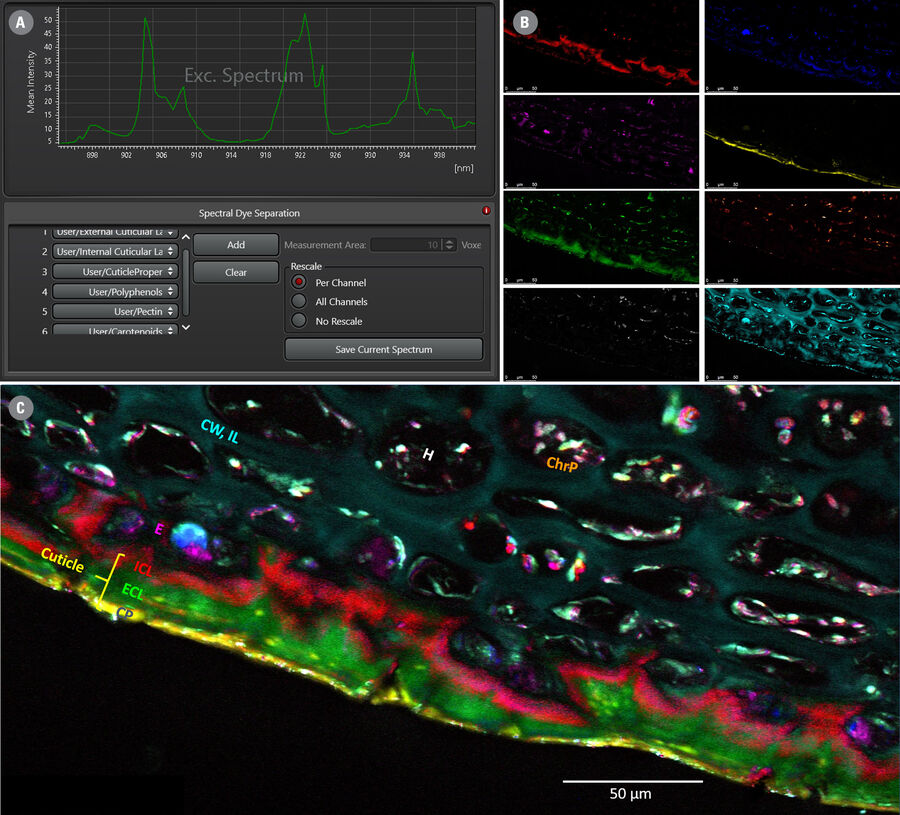
下方图 2 通过一个新鲜苹果切片的光谱分析实例展示该工作流程,重点观察果皮及果肉外层区域的指纹信号。
光谱数据分析:
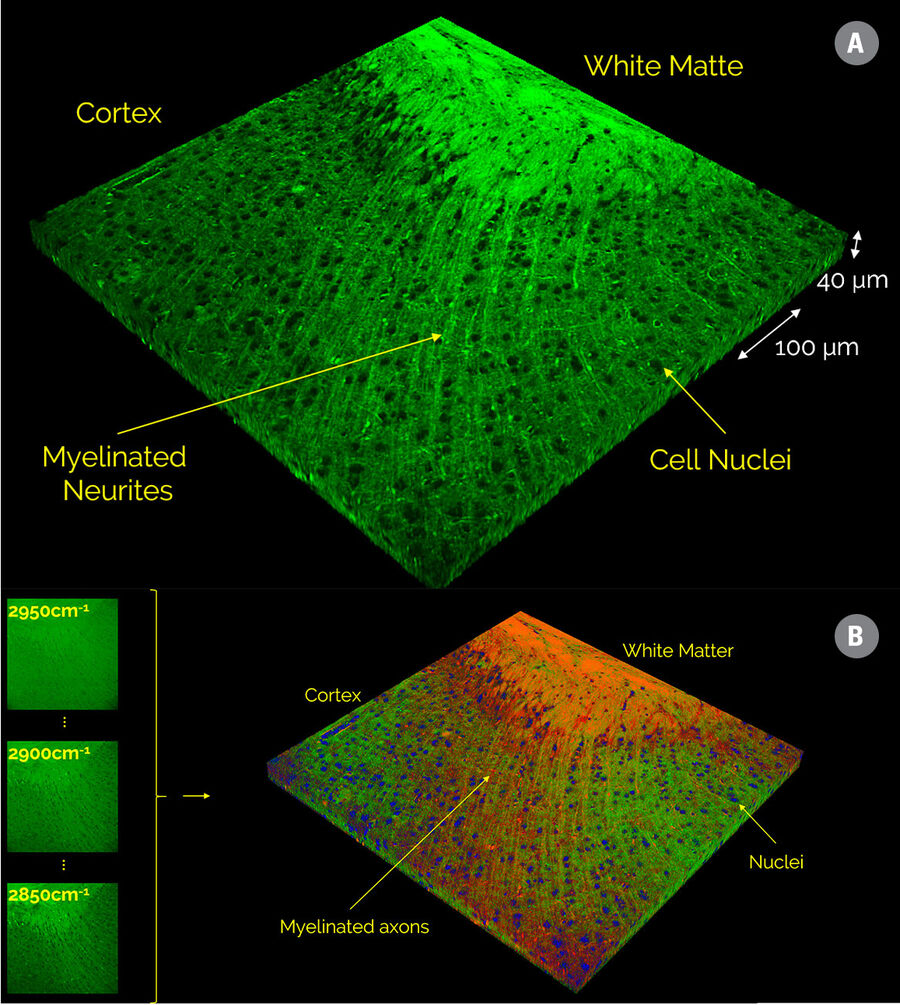
SRS 光谱在数学上与自发拉曼光谱完全相同,因此适用于为自发拉曼光谱开发的相同类型的定量分析程序。实际上,SRS 光谱可能更易于解析,因为几乎不存在荧光背景干扰,因此无需进行诸如背景扣除等数据预处理。
A) 用户自定义光谱分析
用户可自定义进行光谱分析,首先在 LAS X 软件中选择感兴趣区域(ROIs)并显示其光谱,如图 3 所示:在“Quantify”标签页下选择“Stack Profile”,维度设为Λ。注意,光谱的 x 轴可以按振动频率(即拉曼位移,单位为 cm⁻¹)显示,也可按泵浦激光波长λ(单位为 nm)显示。波长单位可通过公式转换为振动频率:
v [cm-1] = 107 (1/λPump[nm]-1/λStokes[nm])
斯托克斯激光波长λ Stokes 是固定的,其精确值可从激光线显示器读取。通过右键点击光谱并选择“导出”至“Excel”格式,可将光谱数据导出。此外,图像感兴趣区域(ROIs)也可保存以备将来在 LAS X 软件中使用(在“Quantify”标签页显示图像时右键点击→“保存ROIs”)。
B) 光谱拆分
基于样品亚结构的光谱特征进行快速直观区分的另一种方法是 LAS X 软件内置的“光谱拆分”功能,如图 4 所示。
在“处理”选项卡下,选择“染料拆分”→“光谱拆分”。同样可选定感兴趣区域(ROI),并将对应光谱保存/导出至染料数据库。随后可从中选取所需数量的光谱作为分离基准。