浮游生物分析材料与方法
甲藻采集采用 5 或 10 微米孔径网具在法国滨海自由城湾表层水域慢速拖网 10 分钟。甲板收集后,样品经 Retsch 系列筛网过滤获取 40 微米以下细胞。实验室处理流程为:1)通过手动泵抽滤在 1.2 微米混合纤维素酯膜(Merck)上浓缩;2)重悬至终体积约 4 毫升;3)1000g 离心 5 分钟。弃上清后,取约 1.2 微升沉淀物装入预先涂覆十六烯(Merck)的金铜 A 型载样台(Leica;深 200 微米,宽 3 毫米),覆盖同样预涂十六烯(Merck)的铝制 B 型载样台(Leica)平面端,使用 Leica EM ICE 进行高压冷冻。
冷冻固定样本经过冷冻置换处理(使用 EM AFS2 型号,Leica 公司),程序及溶液如下:在-90°C 的 2%四氧化锇丙酮溶液中保持 60 小时,以 2°C/小时的速率升温 15 小时至-60°C,于-60°C 维持 10 小时,再以相同速率升温 15 小时至-30°C,保持 10 小时后,以最大速率 1 分钟内升温至 0°C,停留 1 小时,随后以最大速率 1 分钟内冷却回-30°C,并用纯丙酮在-30°C 下洗涤 5 次。
细胞随后逐步渗透 EPON 硬树脂。采用的树脂(不含促进剂)/丙酮(体积比)梯度系列为:25%浓度起始于-30°C,2 小时内升温至-10°C;50%浓度起始于-10°C,以 5°C/小时速率升温 2 小时至+10°C;75%浓度起始于+10°C,以 10°C/小时速率升温 2 小时至+20°C。样本随后在不含促进剂的 100%树脂中分两次渗透,分别为 12 小时和 48 小时。
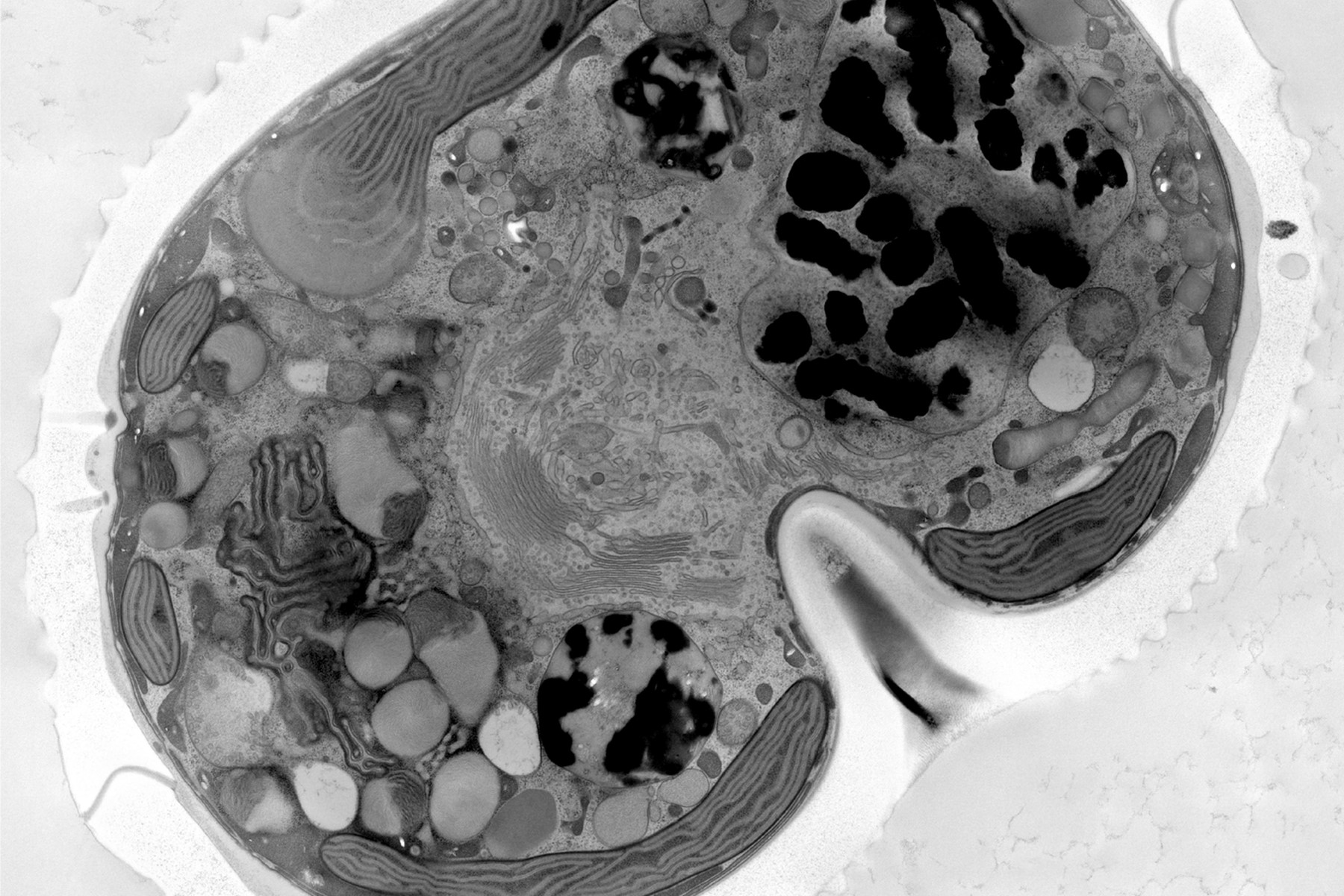
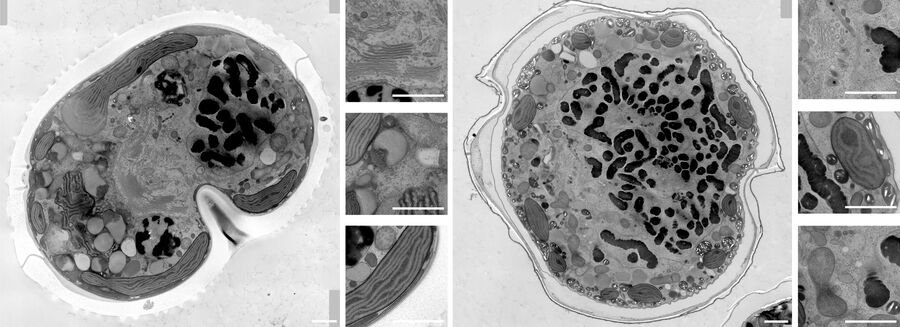
随后用含促进剂的 100%树脂进行两次 3 小时和一次过夜的渗透处理,之后在 60°C 下聚合 48 小时。使用超薄切片机(Leica EM UC7)搭配超薄金刚石刀(Diatome)切制 70 纳米薄片。薄片经 1%醋酸铀水溶液染色 20 分钟和柠檬酸铅染色 3 分钟后进行后染色。通过 SerialEM 软件在 JEOL JEM 2100plus 电镜上以 120 千伏电压和 8000 倍放大倍数采集拼图影像。拼图处理采用 Imod 和 Fiji 软件完成。高压冷冻样本处理由海德堡 EMBL 电子核心显微设施(EMCF)完成。