TIRF 显微镜的技术优势
TIRF 显微镜的一大优势在于其卓越的信噪比。由于衰逝场的穿透深度较浅,离焦荧光被最小化,因此几乎不会产生背景荧光。由于只有细胞的一部分暴露于电磁衰逝波的能量中,有害氧气的生成及由此产生的细胞光毒性压力也大幅降低,这显著提高了细胞活性并允许更长的实验持续时间。此外,低水平的光漂白仅发生在细胞的微小区域,而胞质中不断有新的荧光团补充至该区域,使得信噪比能长时间保持稳定。此外,适用于 TIRF 显微镜的荧光团种类(如 EGFP、Fluo-4 等)广泛,仅受可用激光波长的限制,因此诸如 FRET、FRAP、钙成像等活细胞成像技术可轻松实现。搭配高灵敏度相机还能实现高速图像采集,以观测快速动态过程。 此外,全内反射荧光显微镜(TIRF)可与其他显微技术如落射荧光显微镜和明场对比方法联用。该技术的一个局限是目前仅适用于贴壁培养细胞的研究,因为例如组织切片通常无法足够接近盖玻片/培养基界面以使衰逝波穿透样本。
生命科学研究中的全内反射荧光显微技术
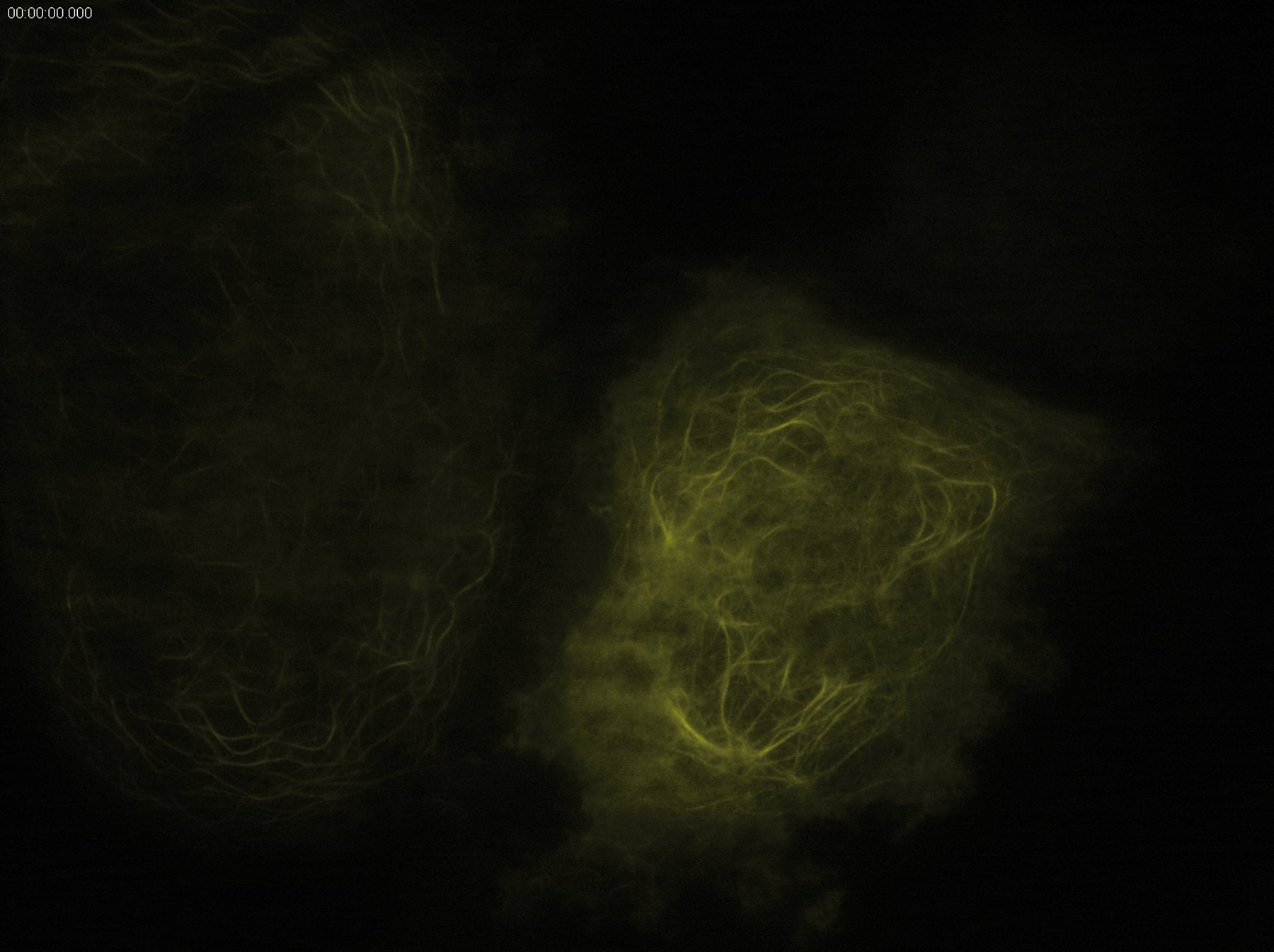
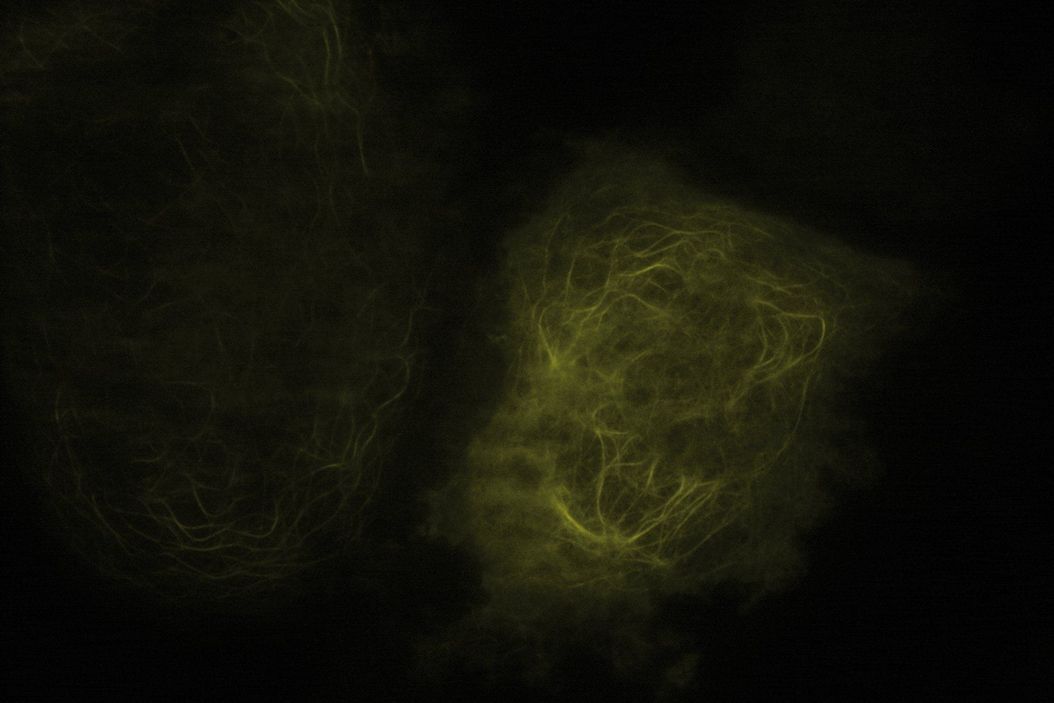
通过利用空间受限的衰逝场激发荧光团,全内反射荧光显微镜能够观测质膜附近光学切片(通常约 100 纳米)内分子的定位与动态过程。这一特性对于研究质膜及其邻近区域的众多生物学过程具有显著优势。
TIRF 显微镜是一种卓越的技术,能够将动力学研究与活体样本甚至体外实验中的空间信息相结合。该技术常规用于研究分子运输过程,例如细胞骨架组装中的动态。TIRF 显微镜的快速图像采集和卓越的背景消除能力,为观察诸如蛋白质募集至质膜等动态事件提供了绝佳条件。例如,可借此研究动力蛋白/驱动蛋白介导的运输动力学。此外,利用 TIRF 显微镜还能追踪线粒体等完整细胞器的运动。在细胞间相互作用研究中,通过 TIRF 显微镜可轻松可视化黏着斑等特殊结构,以观察细胞骨架组分向黏着斑募集的过程。
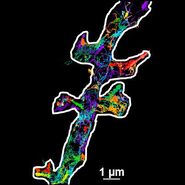
通过将数学模型(如质心追踪法)与全内反射荧光显微镜(TIRF)无与伦比的信噪比和 z 轴分辨率相结合,可实现单分子亚衍射极限定位,精度达 1 纳米。这一成就得益于衰逝波激发荧光团时,离焦荧光团产生的背景荧光极低,从而在样品特定体积(如衰逝波穿透深度乘以视场面积)内获得极低的信噪比。而在传统灯源荧光系统中,光束路径上的所有荧光团会同时被激发和检测,无法获取其 z 轴位置信息。
换言之:荧光团的三维分布仅以二维形式呈现,细胞的不同 z 平面在获取的图像中表现为单一平面。这导致图像中荧光团的重叠,往往使得单个荧光斑点的区分变得不可能。然而,在 TIRF 显微镜中,仅有约 100 纳米深的衰逝波内相对较少数量的荧光团被激发,从而提供了样本的光学 z 切片。
TIRF 图像中荧光斑点间在 x 和 y 方向上的空间邻近性相对较低,因为来自其他 z 平面的荧光团所发射的光不会叠加到检测信号上。若随后应用数学模型(如质心追踪法)计算检测到的荧光分子的质心,则能以 1 纳米的精度实现单分子的亚衍射极限定位。
TIRF 显微镜的另一大应用领域是膜融合过程的研究,如囊泡运输。由于衰逝波仅激发靠近质膜的荧光团,因此可监测内吞囊泡的形成以及分泌囊泡与质膜的融合过程。为此,可通过将外泌货物蛋白标记绿色荧光蛋白(GFP)等荧光蛋白来实现囊泡标记。
由于光学切片技术的应用,荧光强度的变化可被解读为荧光标记囊泡进入或离开衰逝场的运动,或货物释放与摄取的过程。强度缓慢增加表明囊泡正移入衰逝场,即向质膜方向运动。当分泌囊泡与质膜融合时,荧光信号会因货物释放至细胞外空间而迅速减弱。反之,通过使用荧光标记物(如标记葡聚糖)可观察内吞过程,这类物质会被细胞以内吞方式摄取。
质膜上发生的另一重要过程是细胞信号传导(如 G 蛋白偶联受体的信号传递)。在此过程中,可观察到信号级联反应中单个分子(如 G 蛋白)的募集或移动。