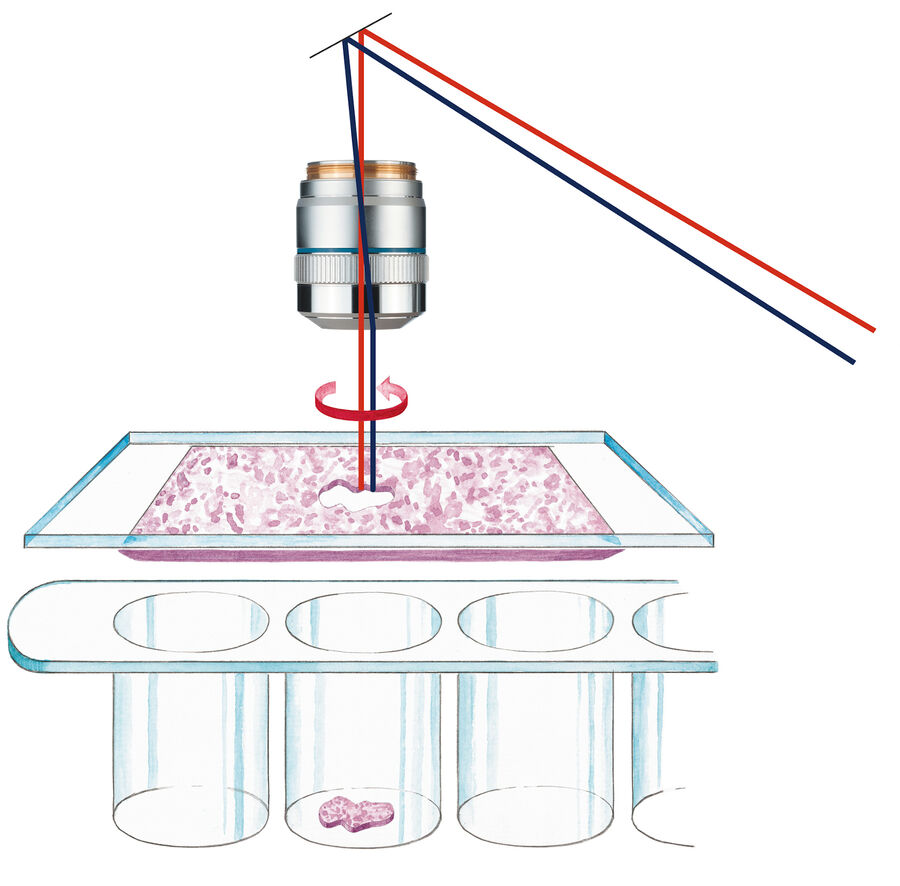
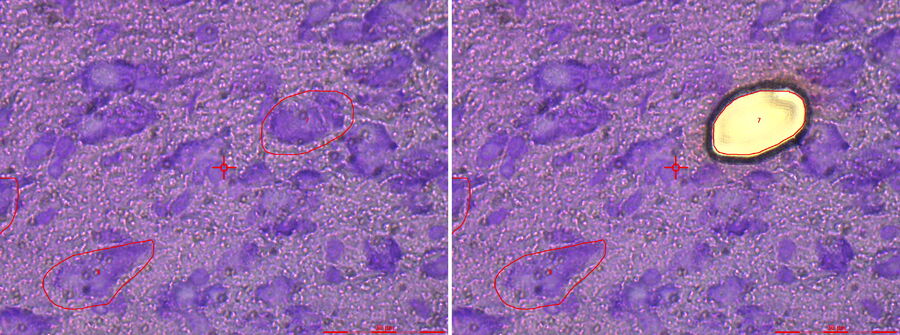
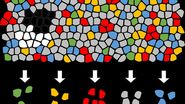
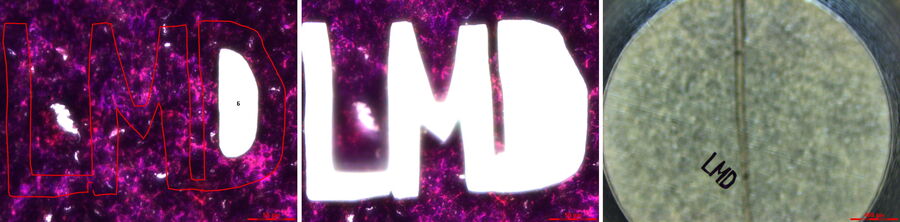起源
最早的激光显微切割系统早在 45 年前的 1976 年就由德国病理学家发明 [1,2]。他们使用直立式 Leitz-Orthoplan 显微镜,并率先发明了重力收集法。这项技术在当时遥遥领先,但似乎随着时间推移被遗忘。或许是因为当时缺乏合适的处理像单细胞这样微小的样本下游分析方法。
20 年前,Leica Microsystems 推出了 Leica AS LMD 系统。与此同时,PCR 技术的发明使得微量核酸作为模板的分析方法成为可能。此外,通过重力作用将多个切割物汇集至同一收集容器的方法,也为质谱分析提供了足够纯净的起始材料,适用于蛋白质组学或代谢组学研究。
总体而言,从科学角度看,激光显微切割技术作为一种工具,可用于区域、细胞乃至染色体层面的特异性研究,有助于构建新知识并验证缺乏特定证据的理论概念。
除癌症研究外,激光显微切割技术(LMD)已征服众多不同应用领域。例如在神经科学中,该技术能分离不同脑层乃至单个神经元 [4,5]。为艾伦脑图谱验证原位杂交结果提供了支持 [6]。在发育研究中,LMD 可实现时序性发育状态下各组织层的精准分离[7]。结合荧光标记技术,能更好的特异收集特定细胞周期阶段的细胞,避免其他周期细胞的污染[8]。活细胞培养虽应用较少,但 LMD 在此领域(如克隆技术)[9]。 利于重力收集,而 LMD7 配备的高功率激光或"激光螺旋"技术甚至能切割原生叶片等厚重材料 [10,11].
法医学是激光显微切割技术的另一重要应用领域。最显著的例子是能够将犯罪者的精细胞与受害者的皮肤细胞分离,从而通过犯罪者和受害者的 DNA 指纹确证,为案件提供确凿证据 [12,13]。
持续改进与创新
徕卡 LMD 的演进历程:自推出以来,徕卡 LMD 系统始终围绕客户需求和期望不断升级,成为连接显微镜技术与分子生物学的可靠研究工具。
主要亮点包括:
2001 年 – 推出 Leica AS LMD 并引入专用荧光模块
2002 年 – 引入自动化图像存储数据库
2003 年 – 为 LMD 推出特殊 150 倍干镜及样本概览功能
2005 年 – 发布 LMD6000、LMD 扫描载物台及模式识别模块
2007 年 – 推出免膜收集的 Draw+Scan 模式
2009 年 – 发布 LMD6500 和 LMD7000 系统
2010 年 – 引入芯片实验室收集装置(现称:通用支架)
2011 年 – 专用 LMD 相机 CC7000 问世
2012 年 – 专为高激光功率应用设计的 10 倍特殊物镜及激光螺旋切割技术
2013 年 – 48 孔收集器、第三方模式识别接口、大区域点对点切割功能
2014 年 – 第 1000 台 Leica LMD 系统售出
2015 年 – 推出 LMD6 和 LMD7 型号,新增阴影切割技术
2016 年 – 数据库报告功能
2017 年 – 推出 LMT350,支持直接收集至 96 孔板,配备特殊 2.5 倍 LMD 物镜
2018 年 – 最终脉冲切割模式
2019-2021 年 – 384 孔板收集选项,形状导入及通量优化
过去 20 年间,Leica LMD 系统的应用领域不仅扩展,系统本身也不断改进以满足用户需求。这种基于与客户紧密交流、逐步完善以充分理解系统需求的开发理念,使 Leica LMD 系统成为当今高标准工作流程的理想工具,尤其适合高通量实验和与人工智能等前沿技术的结合 [14]。癌症生物标志物研究是激光显微切割技术的主要应用方向 [15]。或许 Leica LMD 系统能为未来癌症疫苗研发贡献力量——新冠疫苗首创者 BioNtech 在其传统癌症研究部门就采用了激光显微切割系统进行相关探索 [16]。
徕卡激光显微切割系统前产品经理、现任生命科学事业部研究显微镜与样品制备应用管理经理的 Falk Schlaudraff 博士回忆道,大约五年前他在美因茨 BioNtech 总部安装并培训 Leica LMD7000 系统:“看到 BioNtech 这样顶尖且技术精湛的研究人员应用这项伟大技术,我感到无比自豪。癌症与 COVID-19 的生物标志物研究路径非常相似。过去 20 年激光显微切割技术的成功实践让我确信,无论是与 Thomas Conrads 领导的 WHIRC 团队,还是 Matthias Mann 主导的诺和诺德基金会合作,BioNtech 的研究人员都借助我们的 Leica LMD 系统推动未来医疗进步。我感恩过去那些年能周游世界与研究人员交流 LMD 技术应用,建立富有成效的合作网络与友谊,激励着我助力全球研究人员借助我们的系统,为当今及未来的问题寻找治愈方法、疫苗、生物标志物和解决方案。
参考文献
- 伊森伯格 G,拉特克 PC,许尔斯曼 N,弗兰克 WW,沃尔法特-博特曼 KE:组织培养细胞中的细胞质肌动球蛋白纤维:通过激光微束分离的纤维在 ATP 诱导收缩下的可视化直接证明其收缩性。细胞组织研究。1976 年 2 月 27 日;166(4):427-43。doi: 10.1007/BF00225909。
- 伊森伯格 G,比尔瑟 W,迈尔-鲁格 W,雷米 E:激光显微切割的细胞手术:一种制备方法。显微镜学杂志。1976 年 5 月;107(1):19-24。doi: 10.1111/j.1365-2818.1976.tb02419.x。
- 科尔布勒 K:徕卡显微切割系统:设计与应用。分子医学杂志(柏林)。2000 年;78(7):B24-5。
- Burbach GJ, Dehn D, Del Turco D, Deller T: 海马体各层基因表达的定量研究:激光显微切割技术与定量 RT-PCR 的有效结合。J Neurosci Methods. 2003 年 12 月 30 日;131(1-2):83-91. doi: 10.1016/s0165-0270(03)00232-2。
- Elstner M, Morris CM, Heim K, Bender A, Mehta D, Jaros E, Klopstock T, Meitinger T, Turnbull DM, Prokisch H: 帕金森病与衰老中多巴胺能神经元的表达分析揭示能量代谢转录失调与细胞死亡的关联。Acta Neuropathol. 2011 年 7 月;122(1):75-86. doi: 10.1007/s00401-011-0828-9. Epub 2011 年 5 月 4 日。
- Jones A: 大脑图谱。TEDGlobal 2011。
- Ikeda K, Mutoh M, Teraoka N, Nakanishi H, Wakabayashi K, Taguchi R: Min 小鼠肠道息肉形成过程中血清与小肠黏膜内氧化相关甘油三酯及磷脂酰胆碱的增加。Cancer Sci. 2011 年 1 月;102(1):79-87. doi: 10.1111/j.1349-7006.2010.01754.x。
- Handschick K, Beuerlein K, Jurida L, Bartkuhn M, Müller H, Soelch J, Weber A, Dittrich-Breiholz O, Schneider H, Scharfe M, Jarek M, Stellzig J, Schmitz ML, Kracht M: 细胞周期蛋白依赖性激酶 6 是 NF-κB 依赖性基因表达的染色质结合辅因子。分子细胞。2014 年 1 月 23 日;53(2):193-208. doi: 10.1016/j.molcel.2013.12.002。
- Podgorny OV: 通过重力转移激光显微切割技术实现活细胞分离。生物医学光学杂志。2013 年 5 月;18(5):55002. doi: 10.1117/1.JBO.18.5.055002。
- Hölscher D, Shroff R, Knop K, Gottschaldt M, Crecelius A, Schneider B, Heckel DG, Schubert US, Svatos A: 无基质紫外激光解吸/电离(LDI)质谱成像在单细胞水平上的应用:拟南芥和金丝桃属植物次级代谢产物的分布。植物杂志。2009 年 12 月;60(5):907-18. doi: 10.1111/j.1365-313X.2009.04012.x。
- Pouzoulet J, Scudiero E, Schiavon M, Rolshausen PE: 木质部导管直径影响葡萄藤中血管病原体 Phaeomoniella chlamydospora 的区隔化。植物科学前沿。2017 年 8 月 21 日;8:1442. doi: 10.3389/fpls.2017.0144。
- Di Martino D, Giuffrè G, Staiti N, Simone G, Tuccari G, Saravo L: LMD 作为法医工具在性侵案件中的应用:通过微量 DNA 分型锁定责任人。《国际会议系列》,第 1288 卷,2006 年 4 月,第 571-573 页。
- Leonov S, Zemskova E, Ivanov P: LMD 辅助的单细胞 DNA 分型在法医生物证据中的应用:细胞类型与样本状态问题探讨。《法医科学国际:遗传学增刊系列》,第 3 卷第 1 期,2011 年 12 月,第 e47-e48 页。
- Mund A, Coscia F, Hollandi R, Kovács F, Kriston A, Brunner A-D, Bzorek M, Naimy S, Rahbek Gjerdrum LM, Dyring-Andersen B, Bulkescher J, Lukas C, Gnann C, Lundberg E, Horvath P, Mann M: 人工智能驱动的深度视觉蛋白质组学定义细胞身份与异质性。筹备中
- Bateman NW, Teng PN, Hope E, Hood BL, Oliver J, Ao W, Zhou M, Wang G, Tommarello D, Wilson K, Litzy T, Conrads KA, Hamilton CA, Darcy KM, Casablanca Y, Maxwell GL, Bae-Jump V, Conrads TP: 木星微管相关同源蛋白 1(JPT1):子宫内膜癌中二甲双胍反应的预测与药效学生物标志物。《癌症医学》,2020 年 2 月;9(3):1092-1103. doi: 10.1002/cam4.2729。
- Hartmann K, Schlombs K, Laible M, Gürtler C, Schmidt M, Sahin U, Lehr HA: RT-qPCR 在乳腺癌生物标志物测定中的稳健性:肿瘤细胞含量、导管原位癌及非肿瘤性乳腺组织的影响。诊断病理学杂志。2018 年 10 月 20 日;13(1):83。doi: 10.1186/s13000-018-0760-6。