冷冻透射电子显微镜
一种解决标本制备过程中干燥问题和显微镜真空中水分挥发性问题的方法是在-180°C及以下的特殊支架中,以最低升华速率在冷冻状态下显微分析样品。这项技术被称为冷冻透射电子显微技术(冷冻TEM)或透射冷冻电子显微技术,在过去几十年中已成为结构生物学中不可或缺的工具,并且随着冷冻电子断层扫描的出现,在细胞生物学中也同样必不可少。
对于本身足够薄的样品,如孤立的大分子复合物、病毒或小细胞,冷冻TEM的标本制备基本上可以简化为一个步骤:通过投入式冷冻(浸没冷冻)物理固定。本文介绍了这种技术的基本原理和缺陷,并随附一篇文章介绍了几种最新的应用。
投入式冷冻
成功可视化嵌入冰中的样品的一个先决条件是,在短时间内将水分子固定在适当的位置,不允许形成冰晶,理想情况下会形成无定形冻结(玻璃化)水。在投入式冷冻的情况下,只有使用具有高导热性的合适制冷剂,并且快速浸入样品以确保整个样品快速冷冻,才能实现嵌入冰中的样品实现可视化。合适的制冷剂包括液态乙烷、丙烷或二者的混合物[1],使用温度略高于熔点(分别为-183℃,纯化合物为-188℃)。此外,标本内的任何一点到暴露于制冷剂的表面的距离必须短,即样品必须非常薄。
冷冻TEM中的标本载体必须为标本提供良好的支撑,但几乎没有背景来进一步降低典型未染色冷冻样品的低对比度。它们还必须导电,以避免标本带电和相关问题,如漂移。所有这些要求在一定程度上都可以通过带有穿孔碳膜的标准TEM载网(实验室制造或商用)达到要求。后者具有非常规则大小和位置的孔,便于自动数据采集。可能需要使用辉光放电/等离子体清洗或基质蛋白涂层对载网进行预处理,以允许水溶液均匀扩散或细胞附着。
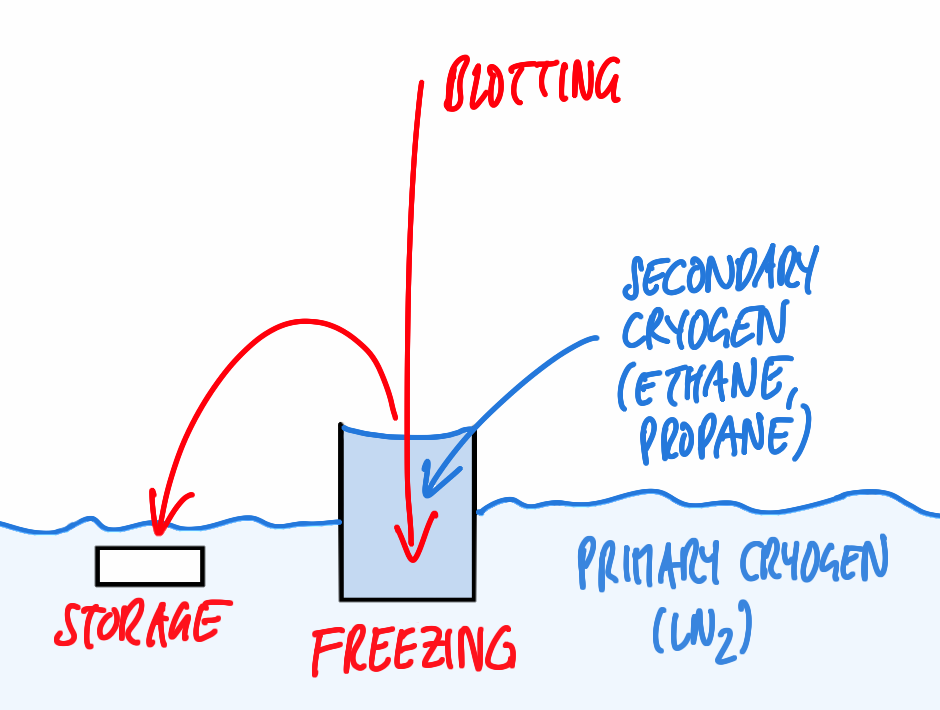
对于基本投入式冷冻,用镊子固定在类似切纸机的装置中(图1),涂抹少量(3–5µl)水溶液中的标本,并用滤纸吸干溶液的主要部分,以减少残留层的厚度。这一步骤对于玻璃化(见上文)和达到显微镜电子束可穿透的厚度都是必要的,对于大多数样品,无需采取进一步的制备步骤。精确的厚度取决于样品和可用的显微镜,通常冰层要尽可能薄,厚度不能超过500nm。这也在所述技术可以有效冻结的厚度范围内。
吸干后,立即将样品迅速放入制冷剂中。冷冻后,样品可以转移到液氮中,在电镜观察之前几乎可以无限期地储存。
挑战
一个关键问题是通过足够快的冷却来产生玻璃态的冰,但也要将冰保持在这种无定形状态:后者要求样品保持在再结晶温度以下。可以通过将载网保持在液氮中或在冷氮气气体环境中,并预冷却操作冷冻标本所需的所有工具达到目的。
另一个主要问题是冷冻标本的表面因湿度冷凝而受到污染,从而形成纳米尺寸的冰晶。由于样品将被冷冻成像并作为一个整体(与冷冻替代或Tokuyasu冷冻切片等通过后续处理步骤去除表面晶体的方法相比),这种污染将在TEM中作为高对比度特征而明显,因此必须避免。这可以通过一些措施来实现,旨在降低周围大气的湿度和样品暴露在该大气中的时间:通常,最好是在除湿室,样品应保持在液氮以下,必须避免在样品表面呼吸,所有转移应使用清洁工具在液相上方的干燥(和冷)氮气环境中快速进行,显微镜必须通过特殊的防污染装置在目标区域提供清洁的真空。
然而,即使是完全冷冻的样品,如果在冷冻前的瞬间处理不当,也可能导致实验失败。问题的一个潜在来源是,如图1所示,仪器上的标本温度不受控制:位于含有液氮的容器上方的未定义位置,样品可能暴露在室温或冷气体中,导致不良状态。
在同一类型的仪器上,尤其是在上述推荐的湿度较低的房间中工作时,溶剂的蒸发可能会产生问题:根据[2],在室温和30%的环境湿度下,水以50nm/s的速率从薄膜中蒸发。溶剂的去除以及随后盐类和其他溶质的富集显然会严重影响从含水标本中获得的结果。
尽管经验丰富的研究人员可以使用图1所示的基本工具取得非常有意义的结果,但上面提到的许多问题仍未解决。因此,实验室已经开始建造自己的仪器,包括环境室和自动吸干器。随后,不同制造商推出了商业产品(回顾请参见[3]),包括徕卡显微系统公司与维也纳IMP/IMBA电子显微镜设施合作开发的徕卡EM GP冷冻投入仪。(图2)。
References
- Tivol WF, Briegel A, and Jensen GJ: An improved cryogen for plunge freezing. Microsc. Microanal. 14: 375–79 (2008).
- Frederik PM, and Hubert DHW: Cryoelectron microscopy of liposomes. Methods Enzymol. 391: 431–48 (2005).
- Dobro MJ, Melanson L, Jensen GJ, and McDowall AW: Plunge freezing for electron cryomicroscopy in: Methods in enzymology 481: 63–82 (2010).