冷冻电子断层扫描工作流程以及冷冻光学显微镜的重要性说明
许多有关人体生理学和病理学的科学问题只能通过研究最基本的细胞机制才能获得解答。这些细胞机制是所有功能性组织、器官及整个有机体的根基。
为了解健康和病理生理学状态下不同细胞类型的功能发挥,因此很有必要确定参与功能实现的生物分子如蛋白质等,同时深入检查分子水平上的相互作用。
为实现这一点,研究中使用了冷冻透射电子显微镜(Cryo TEM),并第一次以低于1 nm的超高分辨率在细胞环境内分辨出生物分子。这种方式之下,单独的蛋白质无需标示就可获得识别,“只需”通过外形就能辨识。此外,即便在细胞质内有不同的构造和分布也能加以区分。
相关文章
THUNDER Technology Note(THUNDER技术说明)
Computational Clearing - Enhance 3D Specimen Imaging(计算清除 – 增强3D样本成像)
Alzheimer Plaques: fast Visualization in Thick Sections(阿尔茨海默病斑块:厚切片快速可视化查看)
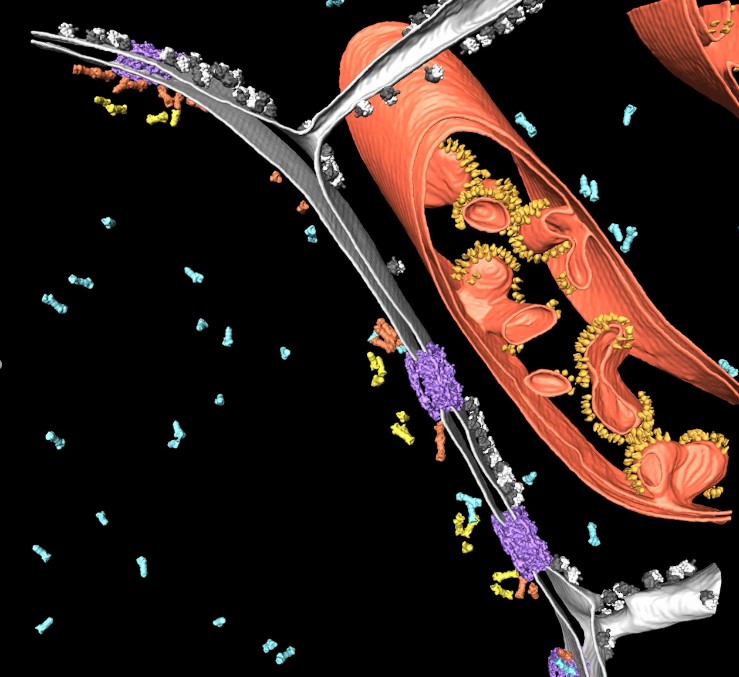
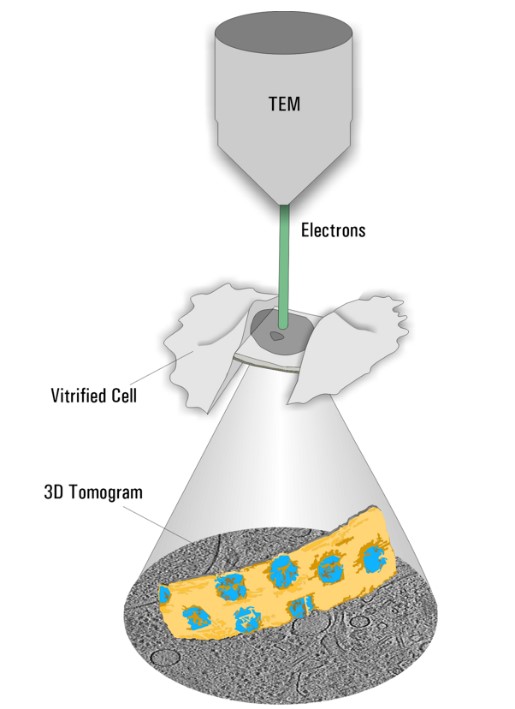
作为先决条件,样本必须使用复杂精密的技术(玻璃化处理)来进行冷冻固定以避免破坏性的冰晶形成。与其他固定技术不同,蛋白质要尽可能维持接近于其原生状态。此后,薄样本(小于300nm)即可在Cryo TEM下进行直接的评估。通过倾斜样本可创建形成观察样本容积的三维数据集并进行重建,从而获得感兴趣蛋白质的3D分布情况(图2,冷冻电子断层扫描)。
为了对样本“更厚”部分进行观察,必须将样本打薄。除了冷冻超薄切片技术外,使用专门的冷冻扫描电子显微镜来进行聚焦离子束(FIB)研磨也是一种可选的方法。两个离子束窗口的定位应确保在感兴趣区域内形成厚度大约200 nm的薄冰片(薄层)。通过这种方式,即便是无法深入研究的样本,也能部分接受Cryo ET的观察(图3,FIB研磨)。
由于整个工作流程较为冗长,所需步骤繁多,而EM上的材料和成像时间又会带来高昂的成本,因此必须及早确定样本质量以及网格上存在的靶区。此外还有一大挑战在于找出精准的研磨位置以确保薄层中含有感兴趣蛋白质。
要克服这些挑战,冷冻光学显微镜就成为了整个工作流程当中非常重要的组成部分。使用冷冻光学显微镜即可对样本质量进行检查,而最为重要的是感兴趣结构的位置可以通过使用基因编码荧光标签来加以确定(图4)。
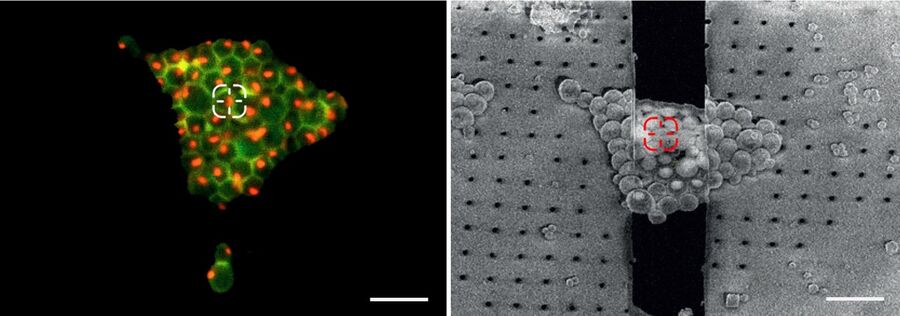
这些标记可选择性地查看,并以2D和3D形式揭示出了所有感兴趣结构的位置。将荧光图像和SEM图像关联起来就能够将潜在的研磨部位联系起来(关联光学与电子显微镜CLEM)。
尽管存在着诸多的挑战(样本的安全低温转移、冰冷部分可能出现的水冷凝、低温下对物镜的使用……),但依然可以使用市售冷冻光学显微镜来加以克服。
冷冻光学显微镜和THUNDER高分辨快速成像
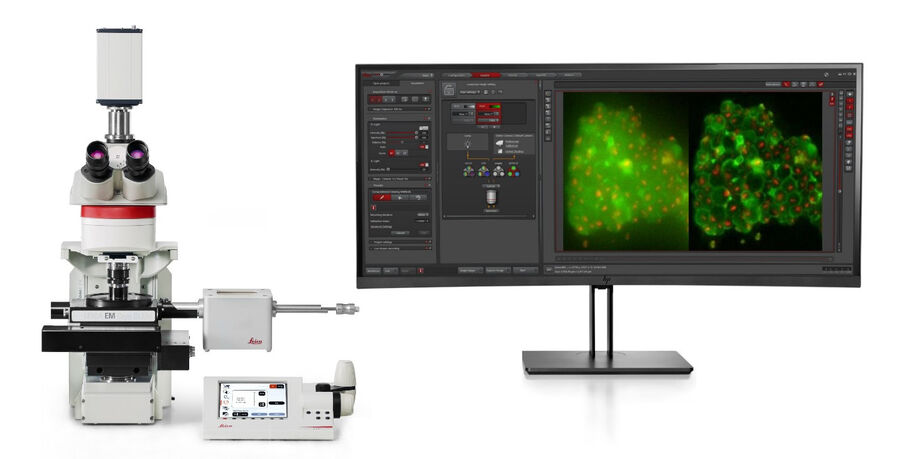
徕卡显微系统提供了专门的冷冻光学显微镜 – 冷冻光电联用系统THUNDER Imager EM Cryo CLEM,其中配备了最新的LED照明和尖端先进的高灵敏度科研sCMOS摄像头(图5)。
不太令人满意的是,尽管宽场显微镜是一种十分灵敏的技术而且非常适合冷冻成像,但常规宽场图像中依然可以观察到背景噪声。这种主要源于样本焦点外区域的背景显著降低了系统的对比度和潜在信噪比(SNR)。导致常规宽场显微镜所记录到的图像通常会显示一层焦外模糊背景,可能无法达到正确定位到感兴趣结构所需的精细分辨率水平。
为解决这一常规宽场成像问题,徕卡显微系统开发了全新系列的成像系统 –THUNDER成像系统,利用ICC光学图像解析 技术作为该成像系统的核心技术。每一次对图像进行采集时会对焦点外模糊背景进行探测并清除,从而实现感兴趣信号的直接可用。与此同时,在焦点内区域当中,样本特征性的边缘和强度依然得到保留。
尤其对于生物学样本,其背景在整张图像内通常无法保持恒定,在视野内的变化较大。计算清除技术可自动解决该问题,从而实现焦点内信号的即刻可见。
THUNDER成像仪提供了三种可选的模式:
- 即刻计算清除(ICC)
- 小体积计算清除(SVCC)
- 大体积计算清除(LVCC)
ICC对应以上所述的计算清除模式。
SVCC和LVCC是计算清除处理与基于决策掩膜的3D去卷积处理的组合,专用于薄层样本(SVCC)或厚层样本(LVCC)。去卷积法的自适应图像信息摘录遵循的概念是由最初针对共聚焦显微镜而研发的徕卡显微系统自适应去卷积法LIGHTNING所演变而来的。
LIGHTNING使用决策掩膜作为基础参照来为图像序列中的各三维像素计算适当的参数设定。结合宽视野点扩散函数(PSF)后,LIGHTNING的功能即可转移用于宽视野探测(更多信息可查看这里)。
THUNDER下的分辨率改善
对单个无重叠衍射限定物体运用小体积计算清除(SVCC)时可使得分辨率增强。在既定示例当中对40 nm直径的单一珠进行了成像(100x放大透镜,NA 1.44)并使用了SVCC。相关样本的结果为分辨率增强*,即横向增强2倍左右(X切面使用SVCC的比率FWHM/原始数据=0.51)和轴向增强约2.5倍(Z切面使用SVCC的比率FWHM/原始数据= 0.39)。
*由点源发射光的表观尺寸定义的分辨率增强。低于衍射限值的两个相邻结构很难彼此分开。
由于THUNDER技术首次成功在环境温度下进行样本成像,因此Leica专家随后提出了在冷冻条件下运用该技术的想法。宽视野冷冻图像的去雾处理尤为实用,因为这种处理不仅能改善图像质量,同时还可以确保更加可靠地为后续EM工作流程步骤(即FIB研磨和TEM分析)识别出感兴趣结构。
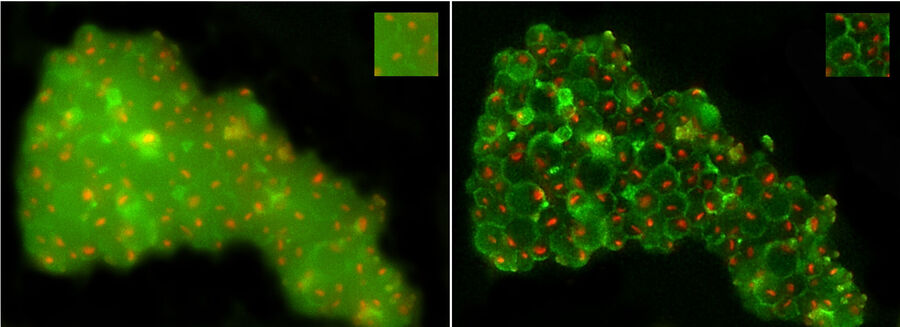
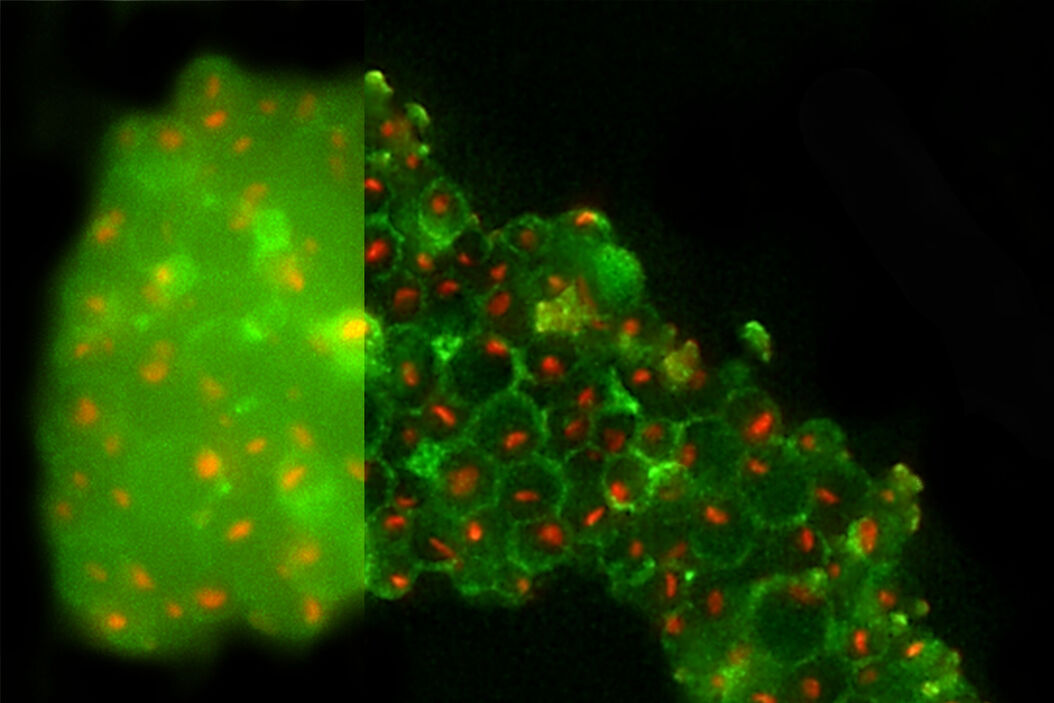
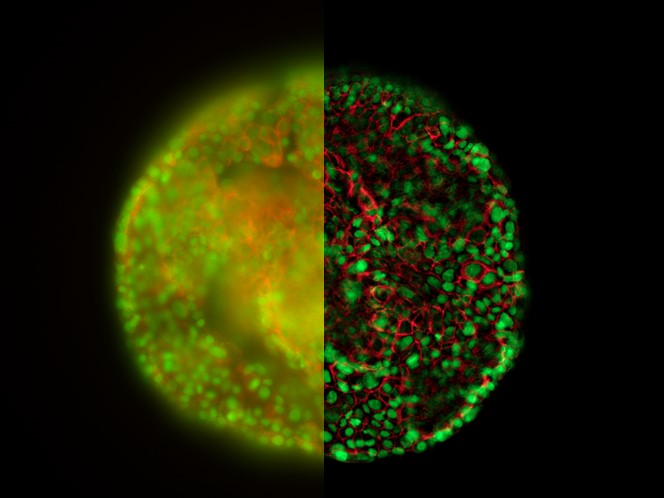
图8显示了使用THUNDER技术(THUNDER LVCC)所观察到的酵母细胞。在左侧面板上可以看到,细胞壁绿色自体荧光的焦点外雾化会干扰对核仁的识别。有人可能认为,绿色荧光可以从重叠图像上移除,但同时还需要对细胞壁进行可视化处理才能识别出核仁并没有发生粘附。运用THUNDER以后,背景雾化部分有所减少,同时又能将信号保留;细胞壁与核仁清晰可见,而且也更容易满足FIB研磨的识别目的。
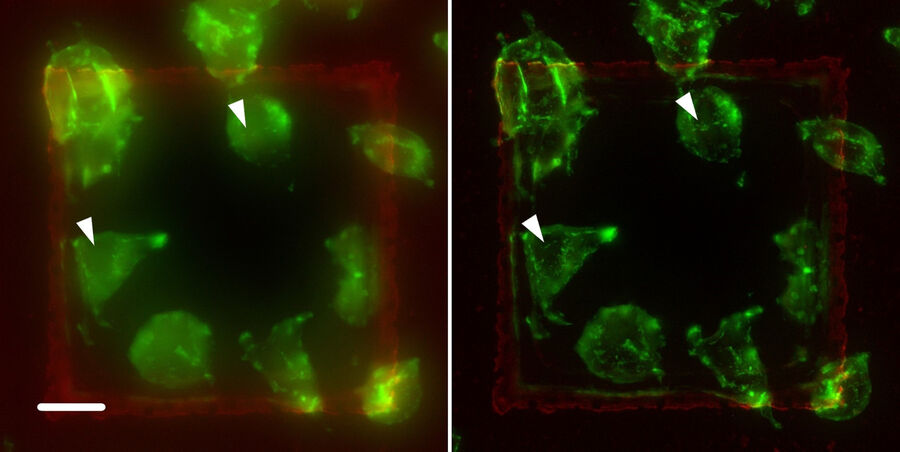
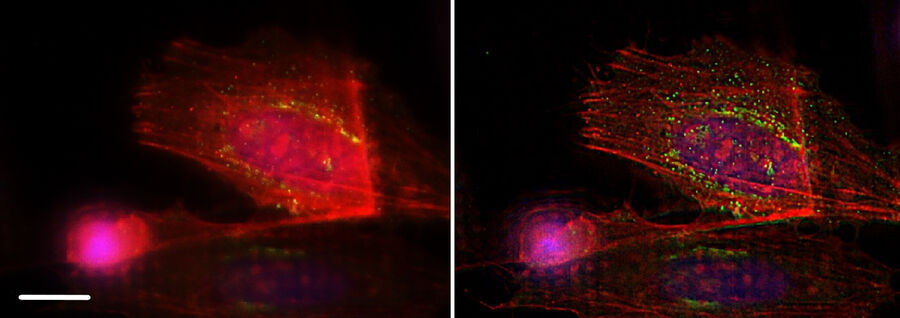
在不同样本上运用了THUNDER技术。图9显示了另一项示例:标记有绿色荧光染料的A9细胞与鬼笔环肽相结合。鬼笔环肽选择性地与纤维肌动蛋白相结合,在真核细胞当中发挥了结构作用。左图中的细微结构被焦点外光线(见箭头处)所隐藏,但在右图中经过THUNDER SVCC处理后得以显示。
F肌动蛋白很适合进行THUNDER成像,因为该蛋白属于薄纤维结构,改善效果能够立即显现。连同mCherry 标示的F肌动蛋白,图10同样显示了水泡结构:高尔基体外侧网状结构(TGN)中的蛋白质TGN46通过GFP荧光进行指示。TGN将新的蛋白质指示到不同的亚细胞目标位置。THUNDER技术在移除掉焦点外光线所产生的模糊影像的同时,还显示了这些小水泡结构。


![[Translate to chinese:] Water Flea Daphnia imaged by Electron Microscopy. Courtesy of Mag. Dr. Gruber, University of Vienna, Austria. [Translate to chinese:] Water Flea Daphnia imaged by Electron Microscopy. Courtesy of Mag. Dr. Gruber, University of Vienna, Austria](/fileadmin/_processed_/e/d/csm_EM_Application_Water_Flea_Daphnia_0d1b51542d.jpg)
![[Translate to chinese:] Projection of a confocal z-stack. Sum159 cells, human breast cancer cells [Translate to chinese:] Projection of a confocal z-stack. Sum159 cells, human breast cancer cells kindly provided by Ievgeniia Zagoriy, Mahamid Group, EMBL Heidelberg, Germany. Blue–Hoechst - indicates nuclei, Green–MitoTracker mitochondria, and red–Bodipy - lipid droplets](/fileadmin/_processed_/6/6/csm_Keyvisual-Cancer-cell-under-Cryo_Coral-Cryo_TechNote_dfb70c27e4.jpg)
![[Translate to chinese:] LNG-non-LNGHeLa cells. Cells kindly provided by I. Zagoriy, Mahamid Group, EMBL Heidelberg [Translate to chinese:] LNG-non-LNGHeLa cells labeled with light blue –Hoechst, Nuclei](/fileadmin/_processed_/c/6/csm_LNG-non-LNGHeLa-cells_8d365432df.jpg)