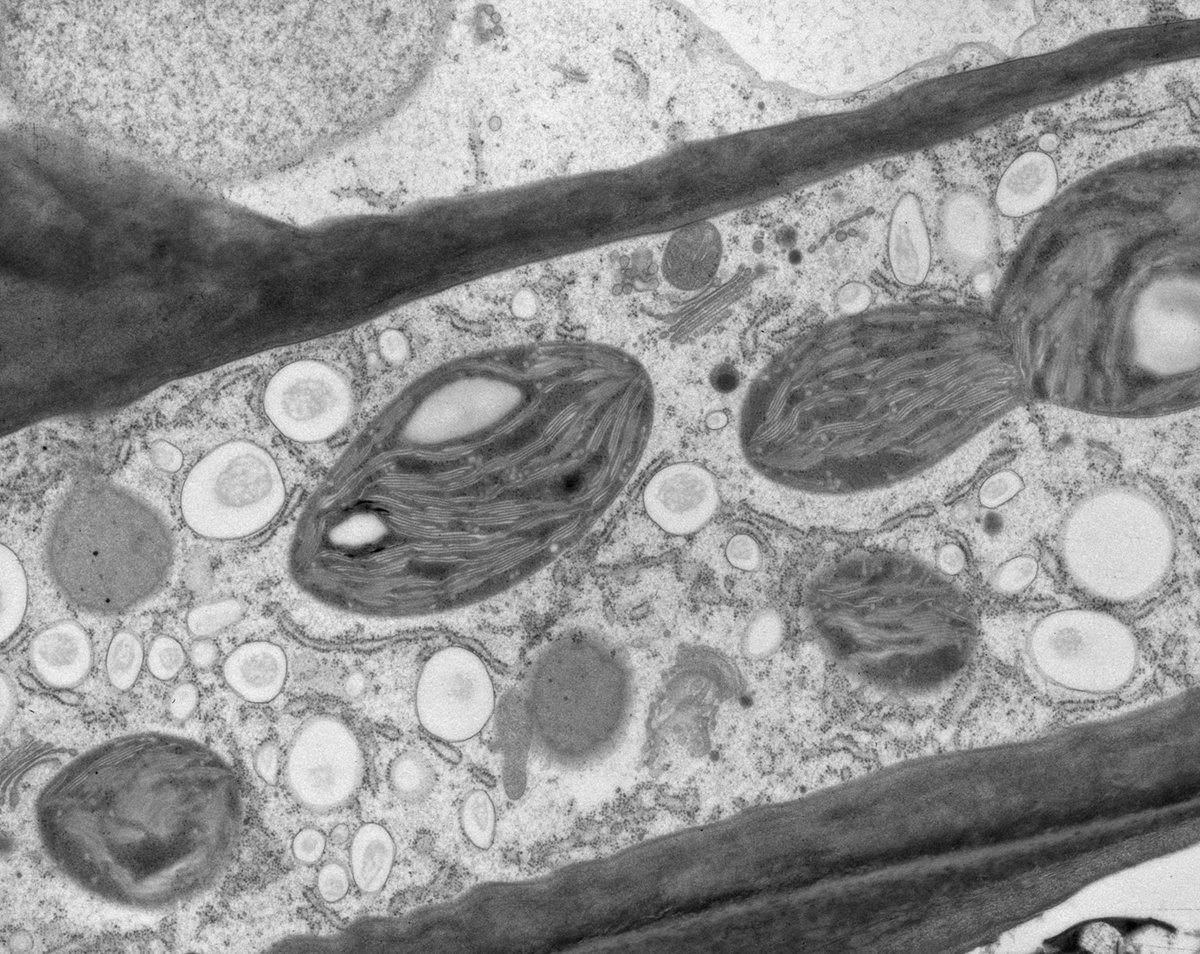
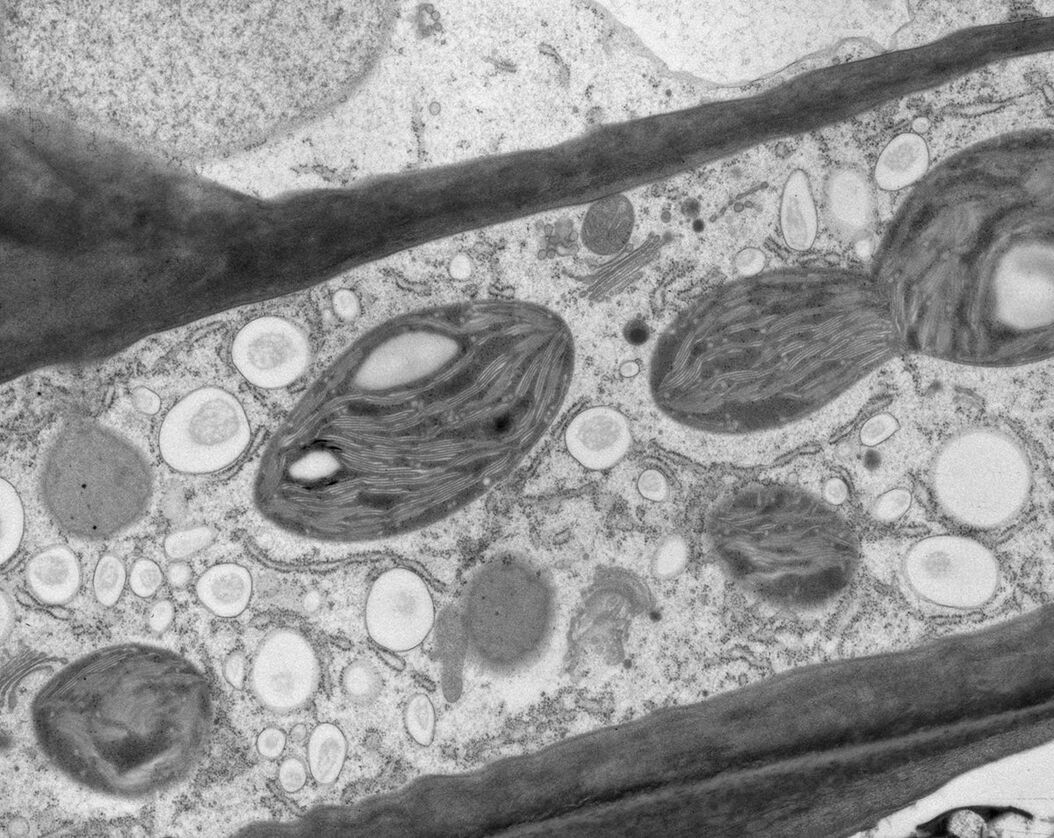
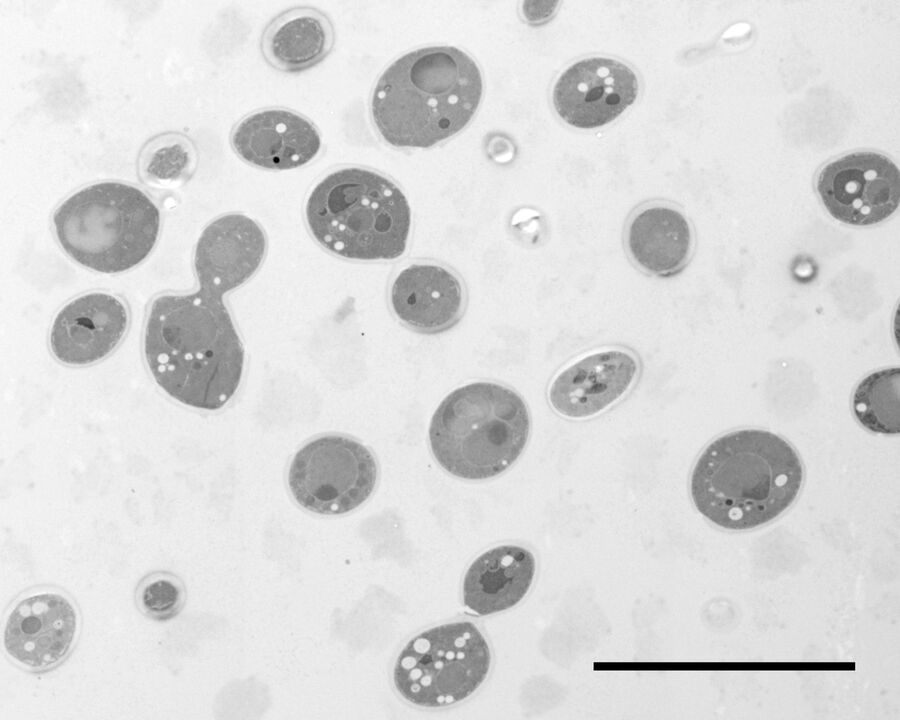
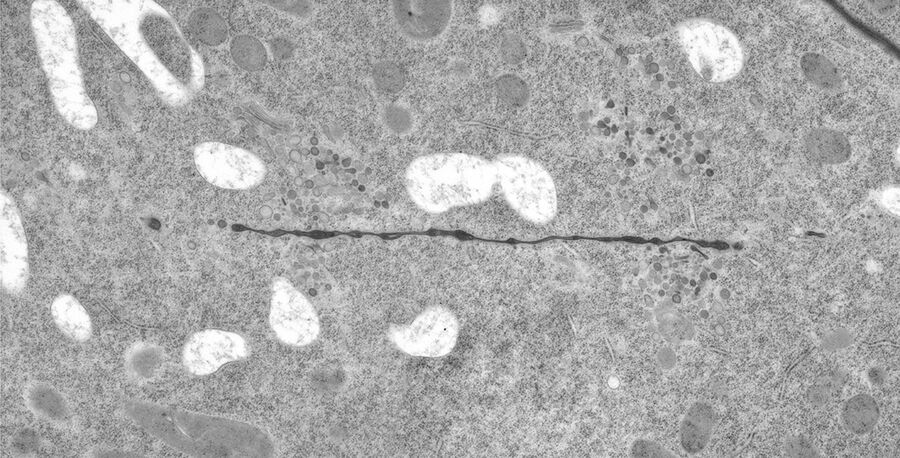
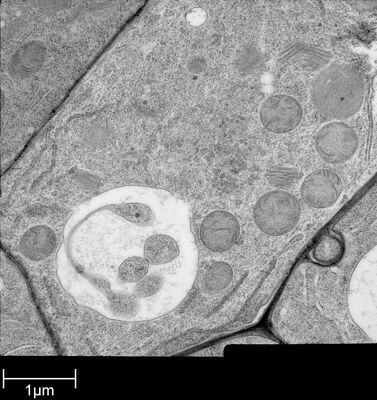
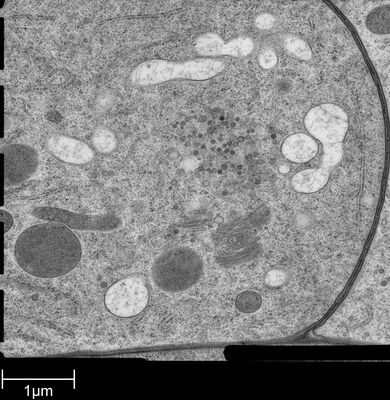
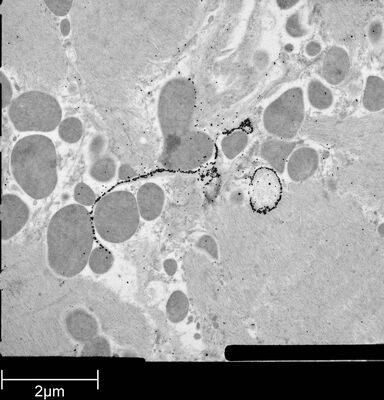
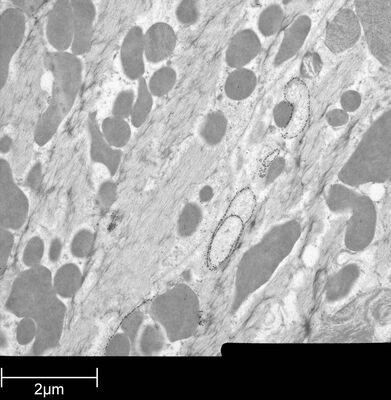
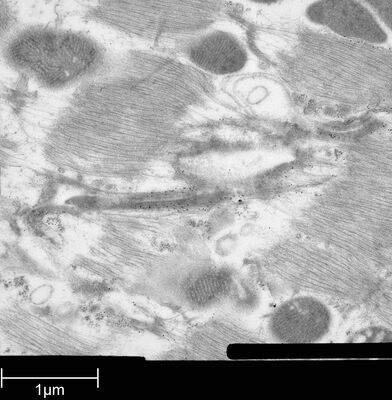
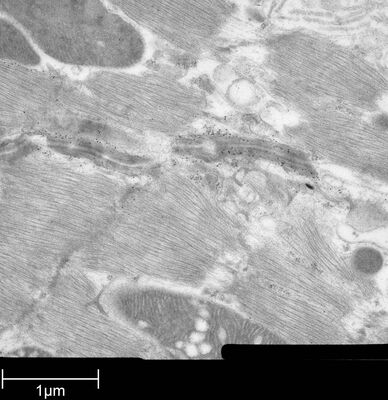
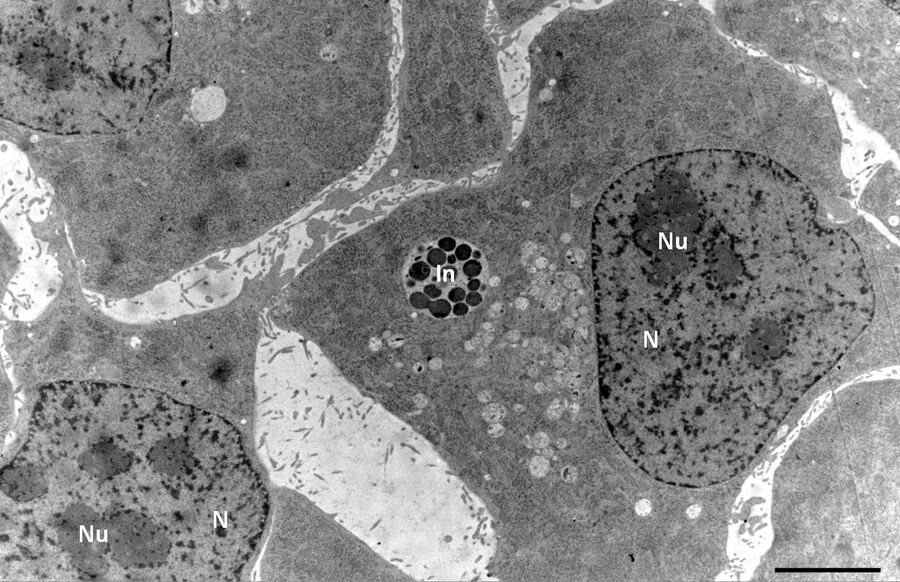
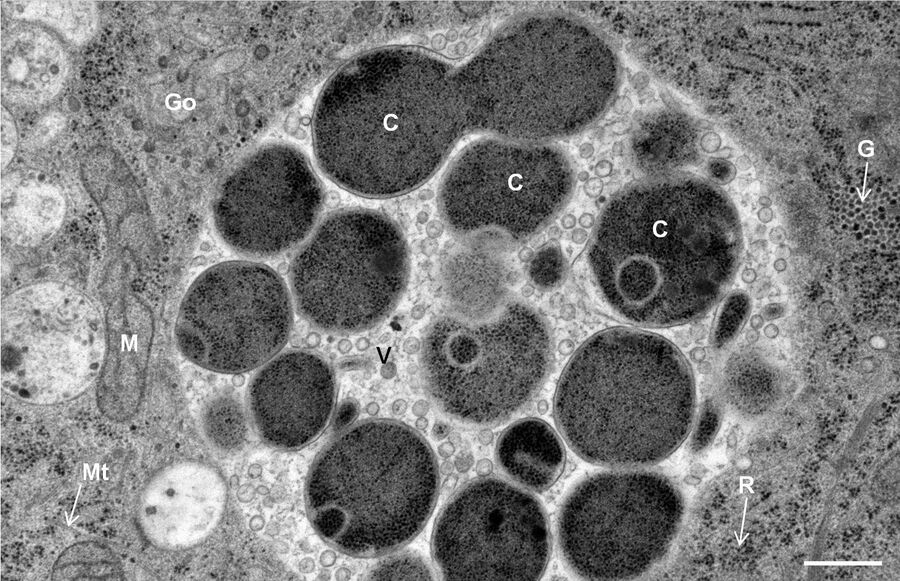
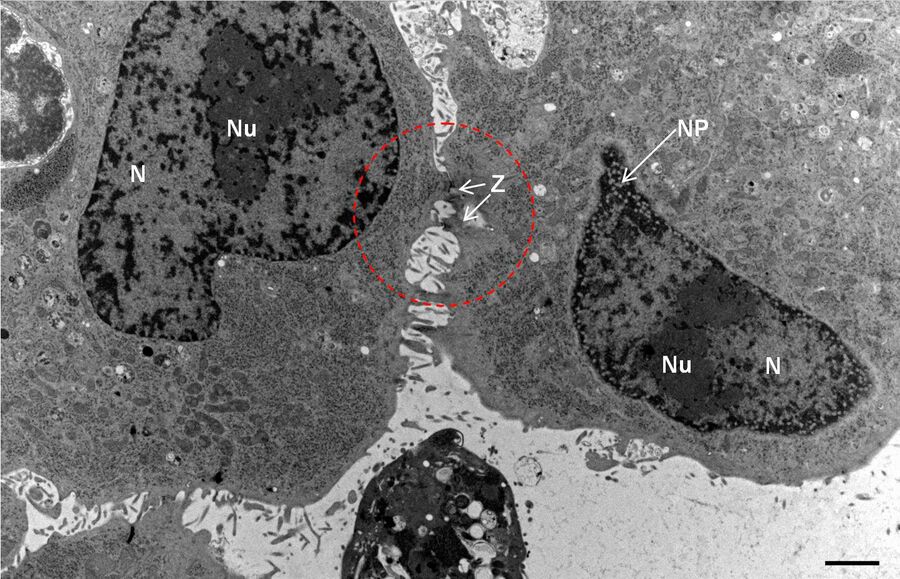
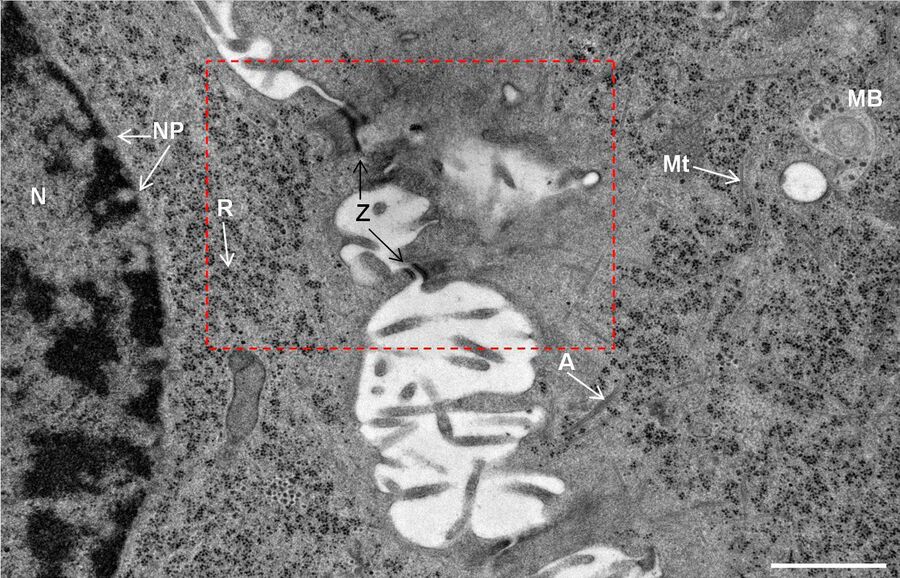
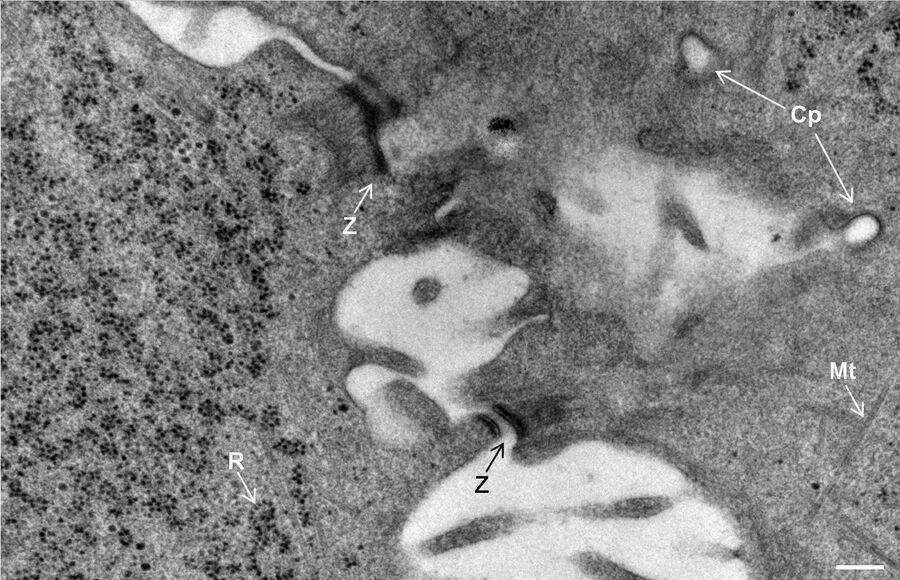
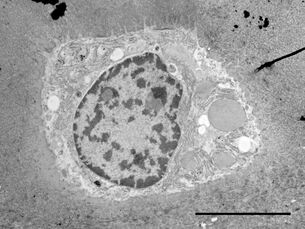
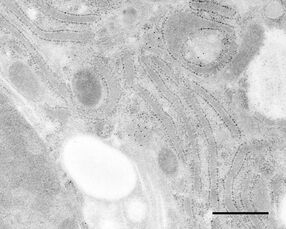
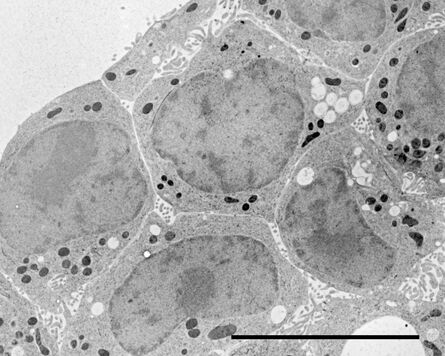
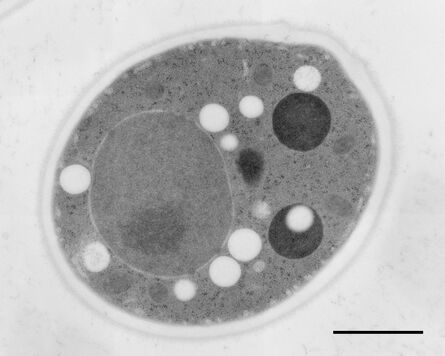
用于形态分析的HPF – AFS实验方案
将拟南芥根(突变体PIN1pro:PIN1-GFP;bex5-1)切下,浸泡于20%(w/v)BSA当中并立即在高压冷冻仪(Leica EM PACT)内冷冻。
冷冻替代则使用Leica EM AFS2在含有1%ddHO、1%OsO4和0.5%戊二醛的干燥丙酮内进行,共持续4天,具体条件如下:
- –90℃下持续24小时,
- 每小时递增2℃,持续15小时,
- –60℃下持续24小时,
- 每小时递增2℃,持续15小时,以及
- –30℃下持续24小时。
然后在–30℃到0℃之间使用纯丙酮对样本进行3次清洗再缓慢加热到4℃,然后在4℃下逐步渗透3天至Spurr树脂中并包埋于胶囊内。在70℃下进行16小时的聚合处理。
使用超薄切片机(Leica EM UC6)制作超薄切片,然后在Leica EM AC20切片染色机当中使用20℃的乙酸铀酰进行40分钟的后染色,再使用20℃的柠檬酸铅进行10分钟的后染色。使用JEM 1010透射电子显微镜(JEOL, 东京,日本)在80kV电压下用来自Ditabis(Pforzheim, 德国)的图像板技术观察网格。
详细内容见参考文献[5]。
小鼠心脏组织免疫电镜的HPF – AFS实验方案
将野生型(WT)小鼠和αT-连环蛋白基因敲除型(KO)小鼠的心脏组织切下,浸泡于20%(w/v)BSA当中并立即在高压冷冻仪(Leica EM PACT)内冷冻。冷冻替代则使用Leica EM AFS在含有2% ddH2O和0.1%戊二醛的干燥丙酮内进行,共持续4天,具体条件如下:
- –90℃下持续24小时,
- 每小时递增2℃,持续15小时,
- –60℃下持续24小时,
- 每小时递增2℃,持续15小时,以及
- –30℃下持续24小时。
然后在–30℃到0℃之间使用纯丙酮对样本进行3次清洗再缓慢加热到4℃,然后在4℃下逐步渗透3天至Spurr树脂中并包埋于胶囊内。使用紫外灯在Leica EM AFS当中进行聚合处理,持续6天,起始温度20℃,结束温度37℃。
使用超薄切片机(Leica EM UC6)制作超薄切片,然后在Leica EM AC20切片染色机当中使用20℃的乙酸铀酰进行40分钟的后染色,再使用20℃的柠檬酸铅进行10分钟的后染色。
使用JEM 1010透射电子显微镜(JEOL, 东京,日本)在80kV电压下用来自Ditabis(Pforzheim, 德国)的图像板技术观察网格。
按照之前所述进行免疫标记处理和标记定量[6]。
免疫-EM使用以下一级抗体:
- Cx43-多克隆兔抗体(1:50;Sigma)和
- 结蛋白多克隆兔抗体(1:50;AbCam)。
在Li等人[7]的文章当中还显示了经处理(使用Leica EM PACT和Leica EM AFS进行处理)用于Spur树脂包埋和HM20(使用Leica HPM010)的其他图像。
实验方案
感染肺炎衣原体的Hep-2细胞在碳涂6mm宝蓝色培养皿当中进行了培养。细胞在使用6 mm CLEM中间孔板的Leica EM HPM100当中进行高压冷冻,其设置如下:含有细胞的宝蓝色培养皿,间隔片200 µm,无细胞宝蓝色培养皿,2片间隔片200 µm。冷却之前使用乙醇作为同步化液体在室温下转移压力。冷冻后将宝蓝色培养皿从浸泡在 –90℃的无水丙酮中的中间孔板内取出并立即移入含有2% OsO4无水丙酮的2 ml Eppendorf试管内,在Leica EM AFS2冷冻替代仪当中预先冷却至–90℃。
样本置换条件
- –90℃下置换8小时
- -60℃下置换8小时,
- -30℃下置换8小时,以及
- 0℃下置换1小时
期间的周期性温度转变梯度为30℃/h。然后使用4℃的无水丙酮清洗2次,在4℃的33% Epon/Araldite无水丙酮内连夜浸泡,而后在4℃的66% Epon/Araldite无水丙酮内浸泡6小时,最后在室温下浸泡于100% Epon/Araldite内2小时,全部浸泡结束后才移入1.5 ml Eppendorf 试管内在60℃下进行至少24小时的聚合处理。使用乙酸铀酰和醋酸铅对切片进行后染色。
注:在蓝宝石片上培养的单层细胞在高压冷冻时不需要使用乙醇作为同步流体。可以使用一种简单的三明治结构来获得类似的结果,即将宝蓝色片置入CLEM中间孔板内,细胞面朝上,盖上一片浸润有1-十六碳烯的铝样品盘,铝盘的100 µm空腔面朝向细胞。
参考文献
- Steinbrecht RA, Müller M: Freeze-substitution and freeze-drying. Cryotechniques in biological electron microscopy. Springer, Berlin, pp. 149–72 (1987).
- Müller M: The integrating power of cryofixation-based electron microscopy in biology. Acta Microsc. 1: 37–44 (1992).
- Hobot JA, Villiger W, Escaig J, Maeder M, Ryter A, Kellenberger E: The shape and fine structure of the nucleoid observed on sections of ultra rapid frozen and cryosubstituted bacteria. J. Bacteriol. 162: 960–71 (1985).
- Kellenberger E: The potential of cryofixation and freeze substitution: observations and theoretical considerations. J. Microsc. 163: 183–203 (1991).
- Feraru E, Feraru MI, Asaoka R, Paciorek T, de Rycke R, Tanaka H, Nakano A and Frimla J: BEX5/RabA1b Regulates trans-Golgi Network-to-Plasma Membrane Protein Trafficking in Arabidopsis. The Plant Cell 24: 1–14 (2012).
- Goossens S, Janssens B, Bonne S, de Rycke R, Braet F, van Hengel J, van Roy F: A unique and specific interaction between alphaT-catenin and plakophilin-2 in the area composita, the mixed-type junctional structure of cardiac intercalated discs. J. Cell Sci. 120: 2126–36 (2007).
- Li J, Goossens S, van Hengel J, Gao E, Cheng L, Tyberghein K, Shang X, de Rycke R, van Roy F and Radice GL: Loss of αT-catenin alters the hybrid adhering junctions in the heart and leads to dilated cardiomyopathy and ventricular arrhythmia following acute ischemia. J. Cell Sci. 15; 125 (4): 1058–67 (2012); doi: 10.1242/jcs.098640.