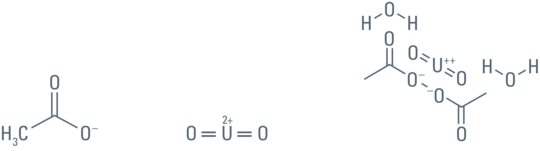介绍
因此,使用醋酸铀(UA)和柠檬酸铅在载网上对超薄切片实施双重染色法成为了电子显微镜当中的标准常规对比技术。尽管这种技术已广为人知,但染色毕竟是电子显微镜样本制备的最关键步骤之一。除手动处理外,使用过的化学品如果具有会导致沉淀伪影的特性,则也属于差错因素。
通过与脂质和蛋白质的相互作用来增强对比度的UA如果不在适当的浓度下使用,且如果剩余UA没有从切片中清除,则会形成一种黄色的针状晶体沉淀。通过与蛋白质和糖原相互作用来增强对比度的柠檬酸铅如果不在完全无CO2条件下使用,则将形成一种不溶于水的有毒白色沉淀物(碳酸铅)。在手动操作过程中避免CO2较为困难,为此需要采用特殊的程序。
通过标准化、封闭、自动化的过程,一方面可以满足重复性、高样本质量、低试剂消耗的科学要求,另一方面则可通过避免与危险试剂接触来满足安全工作环境的要求。
根据这些需求,徕卡显微系统开发出了全自动 Leica EM 徕卡超薄切片自动染色机AC20。通过制备好的预包装UA及柠檬酸铅染色剂来进行自动染色,可确保最大限度地减少用户与试剂的接触,并且能够消除手动染色的传统问题,例如铀或铅沉淀、健康风险和试剂消耗量高等。
染色剂
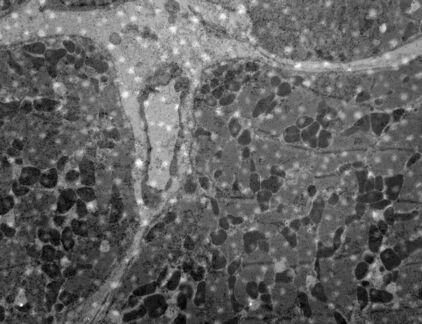
电子显微镜当中使用最广泛的染色剂是重金属铀和铅。利用UA和柠檬酸铅的双重对比法是电子显微镜的标准染色技术(图1和2)。
在本章节当中我们将讨论UA和柠檬酸铅的特点并根据染色过程来探讨其优缺点。
UA的缺点在于对光尤其是UV(紫外线)较为敏感,如果暴露在外将出现沉淀。老化时也会出现沉淀。此外,UA具有放射性和毒性。正常市售储备液具有0.37– 0.51 μCi/g的典型放射性。这是一种非常轻微的放射性水平,不足以对人体产生危害……
酒精醋酸铀
酒精染色剂的优点在于能够更容易地渗透到塑料包埋的组织当中,因此只需要很短的染色时间就可以获得高对比度。
酒精溶液通常在50-70%的乙醇或干甲醇当中制作成饱和溶液。
在甲醇中可获得较高溶解度。因此采用饱和甲醇醋酸铀染色时应该可获得较高对比度。
酒精,尤其是甲醇醋酸铀,属于一种化学侵蚀性溶液。因此在使用甲醇醋酸铀时应考虑加强对细胞物质的提取。酒精醋酸铀能溶解胶体素-火棉支撑膜,而如果染色时间得到延长则甚至能溶解聚醋酸甲基乙烯脂(formvar)膜。这种物质对许多塑料和橡胶还有破坏作用。
水性醋酸铀
为了获得UA染色剂的特定效果,其应作为水溶液来加以使用。
UA溶于水中时,溶液的pH值在4.2到4.9之间,具体取决于浓度(0.5%到3%)。在这个pH值下,带正电荷的铀占主导地位,且染色液提供了充分的对比度。带负电荷的分子如核酸等的染色效果特别好。
水性染色剂在这个pH范围内并不稳定而且光敏度较高。溶液老化和光照会导致包括氢氧化铀和四价氢氧化铀的沉淀物出现。
存在某些特定的有机离子时四价铀也会发生沉淀,例如包埋介质的未聚合单体,如下所示:
稳定溶液
需要确保UA稳定才能避免长时间存放所出现的沉淀。通过酸化来稳定UA时可完全避免沉淀发生。但酸化处理又会大幅减弱染色效果。pH为3.5时,铀离子与DNA的结合度很强,而且比pH 4.0时更为特异,因为在这个pH值下只有DNA带负电荷。在pH 3.5以下,铀染色与组织成分的反应非常微弱,因为大多数蛋白质甚至核酸在较低的pH值下不再带负电荷。
制备4%(w/v)水性醋酸铀储备液
注意:UA因为结合了化学毒性和轻微放射性而具有极高毒性,长期接触有累积效应的危险。称量粉末时要小心,始终戴好乳胶手套、实验服、防护面罩和其他适当的防护用品(请联系实验室安全员!)
材料
- 乳胶手套、实验服、防护面罩
- 200 ml棕色储备瓶(严格清洗干净!)
- 100 ml量瓶(严格清洗干净!)
- 50 ml移液管(严格清洗干净!)
- 通风罩下的天平
- 称量盘
- 加热板
- 磁力搅拌器和搅拌棒
- Whatman #1滤纸
- 玻璃漏斗
- 醋酸铀二水合物粉末(无水)[U(C2H3O3)2× 2H2O],4 g
- 无CO2双蒸馏水,125 ml
注意:玻璃器皿一旦受到重金属染色剂污染,就不能再用来制备其他化学溶液。
程序
1. 在通风罩下称量4 g的UA(注意穿戴防护用具!),并将其添加到100 ml量瓶内。将96 ml接近沸腾的无CO2双蒸馏水移入装有UA的量瓶内。
2. 放入搅拌器至乙酸铀酰二水合物粉末完全溶解为止。这可能需要一点时间。溶解后使溶液冷却至室温。
3. 经Whatman #1滤纸将UA过滤到200 ml棕色瓶内(光保护),将其盖紧并加贴标签。该储备溶液可在4℃下存放数月。
4. 将玻璃器皿中的UA溶液冲洗入废液瓶中之后,与实验室的玻璃器皿分开存放。被UA污染过的固体废弃物应作为放射性废弃物弃置到存放固体废弃物的容器内(请联系实验室安全员!)。
柠檬酸铅
柠檬酸铅可增强多种细胞结构的对比显影效果,如核糖体、脂膜、细胞骨架和细胞质的其他部分。对比效果的增强取决于与还原锇的相互作用,因为它允许铅离子附着在分子的极性基团上。锇通常用作固定剂。柠檬酸铅与UA的相互作用较弱,因此在UA染色后采用柠檬酸铅染色。
柠檬酸铅的缺点是其在实验室条件下的不可预测行为以及耗时耗力的精细制备(见图7)。柠檬酸铅在二氧化碳存在的情况下很容易沉淀,无论是在空气中还是在用于制备染色剂或冲洗的水中。碳酸铅(PbCO3)是一种不溶于水的有毒白色沉淀物,因此不会溶解在冲洗水中。一般来说,所有的铅盐,如柠檬酸铅都有剧毒。
材料
- 50 ml量瓶,带塑料塞或玻璃塞(严格清洗干净!)
- 25 ml移液管(严格清洗干净!)
- pH计(严格清洗干净!)
- 无CO2双蒸馏水100 ml(新鲜制备并冷却到至少25℃)
- 1 N NaOH,10 ml(于无CO2双蒸馏水当中新鲜制备)
程序
1. 将1.33 g硝酸铅、1.76 g柠檬酸钠和30 ml无CO2双蒸馏水混合到50 ml容量瓶中。用力摇晃溶液几分钟后在30分钟内再摇晃5-6次。这将产生一种没有大颗粒的乳白色铅斑悬浮液。如果看到大块则继续摇晃直到颗粒离解,或者重新进行操作。在搅拌板上搅拌直到乙酸铀酰二水合物晶体(图3)溶解为止。这个过程需要一点时间。溶解后,让溶液冷却到室温。
2. 搅拌时向悬浮液中添加5至7 ml 1 N NaOH。乳状液应变清澈。如果没有,再滴几滴NaOH,总计8 ml。如果溶液仍然不清澈,说明有问题,应丢弃染色剂!将玻璃器皿中的UA溶液冲洗入废液瓶中之后,与实验室的玻璃器皿分开存放。被UA污染过的固体废弃物应当作为放射性废弃物弃置到存放固体废弃物的容器内(请联系实验室安全员!)。
3. 取少量干净染色剂用pH计检查pH值。pH值应为12.0 +/- 0.1。如果pH值过低,在步骤2的量瓶中向澄清溶液中添加更多NaOH。如果pH值高于12.1则重新进行操作。
4. 对pH值加以验证后将无CO2蒸馏水添加到量瓶使溶液的最终容量变成50 ml。量瓶应使用塞子盖紧。
5. 如果密封严密,该溶液的保质期可达6个月。使用前进行离心分离处理(5,000 × g/10 min)或通过微过滤器。
注意:确切了解该染色剂的pH值至关重要。如果pH值与pH 12.0相比,差异超过0.1个单位则将出现染色效果不佳或出现沉淀。
染色程序
染色显影
在电子显微镜样本的制备过程中,切片的手动染色是大多数操作失败所经历的一步。在这一步,载网被滴上几滴UA溶液,并在一定的培育时间后用镊子清除(图8a和8b)。然后用水冲洗载网几次之后,再放置几滴柠檬酸铅进行培育(图9a和9b)。为了防止柠檬酸铅暴露在CO2中而沉淀,在染色皿(此处为皮氏培养皿)中加入NaOH颗粒以排除大气中的CO2。此外,冲洗水应不含CO2(二次蒸馏)。染色后,在几个水浴槽中用喷水再次冲洗网格(图9c)。在芯吸干燥后即可对网格进行分析。
手动染色程序的主要问题在于染色过程中出现的金属盐沉淀,特别是铅的沉淀。使用NaOH颗粒来减少沉淀是一种常用的技术。即便采取了最好的预防措施,在染色的关键半小时内,沉淀也可能会破坏数小时甚至数天的工作。
另一个常见的问题是反复处理网格,这很容易损坏支撑薄膜甚至切片。
由于其中包含了很多手动操作步骤,因此在整个染色过程中用户必须在场。另外,只有少量载网可以同时染色时,该过程必须经常重复。因此,手动染色大大增加了EM实验室的工作量。如果要进行多序列或长序列切片的染色,尤其是当所进行操作的染色时间较短时,就难以获得一致的再现性,有时甚至不可能获得。
最后,由于在制备染色剂以及染色的过程中反复处理危险化学品而增加的健康风险也是手动染色处理的主要缺点之一。
染色
LeicaEM AC20徕卡超薄切片自动染色机可自动完成载网上超薄切片双重染色,使这一传统手动技术自动化。该技术的设计解决了传统手动染色存在的沉淀、染色结果不均匀等问题。此外,通过同时对比多达20个载网,自动化加速了实验室的日常工作,并实现了染色结果的标准化。因此,全自动EM AC20染色机通过消除传统染色问题、降低健康风险并使技术人员获得更多的时间来从事更有意义的工作,对电子显微镜实验室的常规操作进行了广泛的改进。
该仪器使用预先包装、稳定的醋酸铀和柠檬酸铅溶液,以尽量减少用户与危险化学品的接触,并消除因受控和标准化的染色剂制备和装瓶而产生的沉淀和污染(见第2章)。徕卡EM AC20的核心是蠕动泵和非接触式阀门系统,意味着试剂只通过气封室管道。该泵阀管系统包含两个独立的管道设置。其中一个允许控制试剂流并使其冲洗到载网室(图9b)。另一个引导废弃物从载网室内转移到特定的废物瓶。
一般因素
固定剂
四氧化锇固定剂增强对比度。通过与醋酸铀和柠檬酸铅的相互作用,在染色期间作为固定剂和对比度增强剂。研究表明,固色时间对醋酸铀对比获得的对比度有一定影响。铀与卡可基酸盐和磷酸盐离子发生强烈反应,导致铀盐沉淀。因此,当样本经过广泛固定后进行冲洗时,可获得较高的对比度而无沉淀。
即使在脱水和包埋后,磷酸盐缓冲液仍能留在组织中并且常常在肌肉和神经组织中形成较小的局部致密沉积物。
冲洗水
冲洗水的CO2含量通过引起碳酸铅沉淀而影响到对比度。新鲜蒸馏水的pH值接近中性。如果使蒸馏水长时间静置,空气中的CO2就会溶解。
此外,冲洗水pH<6.0时会降低醋酸铀的对比度,因此也会降低总体对比度。如果水的pH值低于6.0,应加入KOH中和。冲洗水也应脱气或煮沸以防止形成气泡,气泡(如有)附着在染色室的载网上会导致无法染色。
包埋介质
现已发现,Epon和Epon的替代品对比方式相似,因此不需要特别的处理。环氧树脂粘合剂(Araldite)已知是一种固有的背景染色剂。因此推荐在较低温度下采用更短的对比显影时间。包埋剂(Spurr)通常需要较长的对比显影时间。当进行包埋剂(Spurr)染色时,不应升高温度,因为树脂背景染色剂本身,例如Araldite,就有吸收染色剂的功能。包埋样本的年龄很重要,因为包埋材料在储存期间会继续聚合。旧样本和切片需要更长的醋酸铀染色时间。
切片厚度
薄切片显示的对比度较厚切片低,但分辨率更高,因为染色剂的结合位置更少。因此薄切片比厚切片需要更长的染色时间。
聚合水平
聚合性差的包埋介质柔软,不易切割并且会迅速吸收染色剂。因此推荐在较低温度下采用更短的对比显影时间。
块染
近年来,包埋前都会对样本进行对比以增强对比度而不形成沉淀。
但在大多数研究当中,单独的“成块”染色并不能充分增强样本的对比度。在大部分教科书中切片染色后都推荐使用醋酸铀和柠檬酸铅。