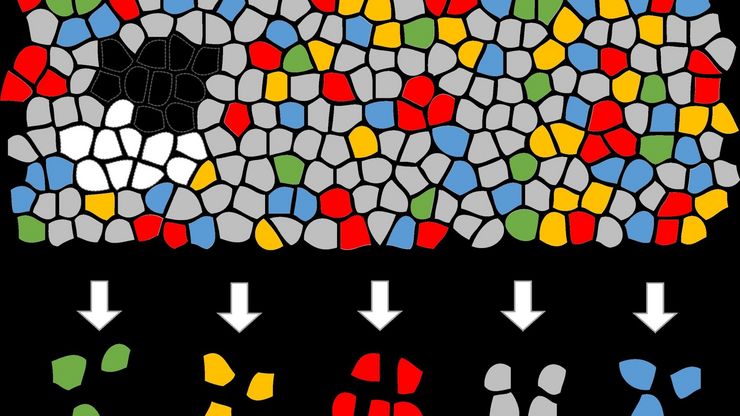
聚合物透射电镜分析用超薄切片技术
本文全面展示了徕卡UC Enuity超薄切片机在聚合物样品超薄切片制备中的优异表现,无论是常温还是低温环境,它都能提供理想的分析样本。文中展示的高分辨率二维及三维TEM图像,有力印证了该仪器在聚合物结构分析领域,对于获得精确、可重复的样品制备结果不可或缺。
利用激光显微切割发现生物标记物
探索空间蛋白质组学工作流程的潜力,如深度视觉蛋白质组学(DVP),以破译病理机制和发现药物靶点。蛋白质表达、丰度或活性的改变会严重影响细胞功能--通常会导致疾病。值得注意的是,相邻细胞之间的蛋白质组可能存在巨大差异。空间蛋白质组学关注到这种细胞异质性,从而揭示了病理机制。激光显微切割技术(LMD)可获取单细胞进行下游分析,同时保留其空间环境,为空间蛋白质组学奠定了基础。
如何深入了解类器官和细胞球模型
在本电子书中,您将了解3D细胞培养模型(如类器官和细胞球)成像的关键注意事项。探索创新型显微镜解决方案,来实时记录类器官和细胞球的动态成像过程。
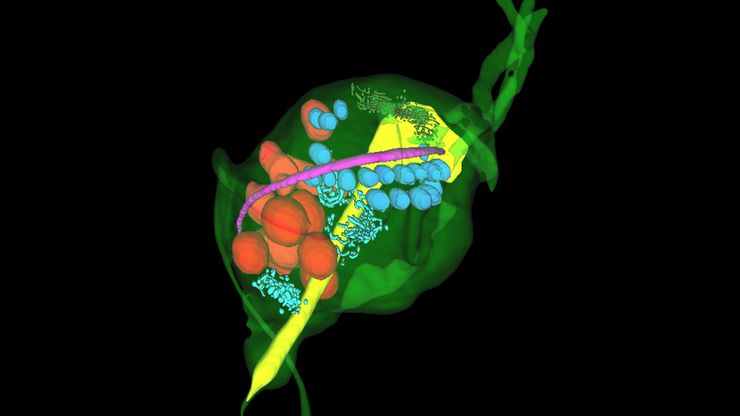
体电子显微学与人工智能图像分析
该文章详细阐述了利用体电子显微镜技术 (volume-SEM) 结合人工智能辅助图像分析,对生物组织进行三维研究的工作流程。研究的重点是一种名为毛滴虫的原生动物,这是一种有鞭毛的寄生虫,是导致性传播感染——滴虫病的病原体。为了可视化其复杂的内部结构,研究人员采用了体电子显微镜技术,通过对一系列超薄切片进行成像来重建三维模型。
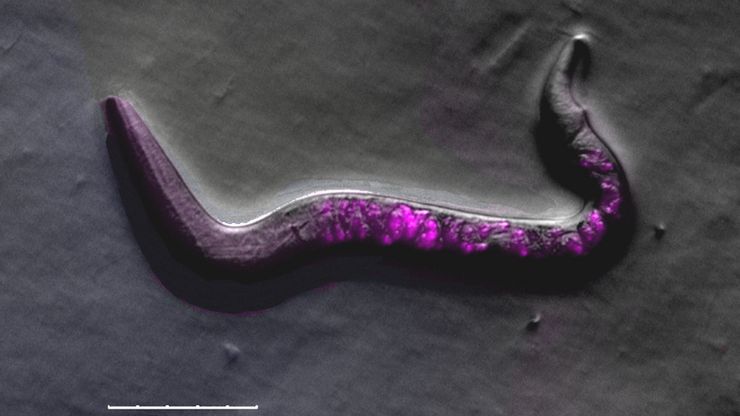
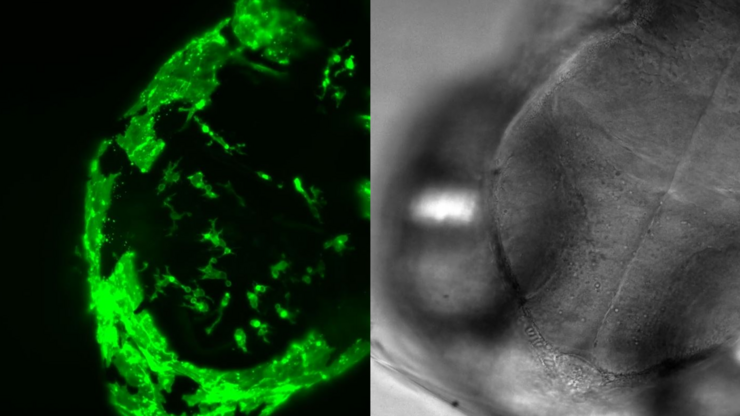
线虫研究指南 - 针对线虫的相关工作
本指南概述了可以高效进行线虫的研究显微镜技术。线虫是一种广泛使用的模式生物,与人类有大约 70% 的基因同源性,是研究发育、神经科学、遗传学和衰老的理想生物。它的透明性和易培育性使其成为一个出色的遗传学模型系统。它可以进行高分辨率成像。主要的实验方法包括挑虫、转基因、荧光筛选、成像和记录。
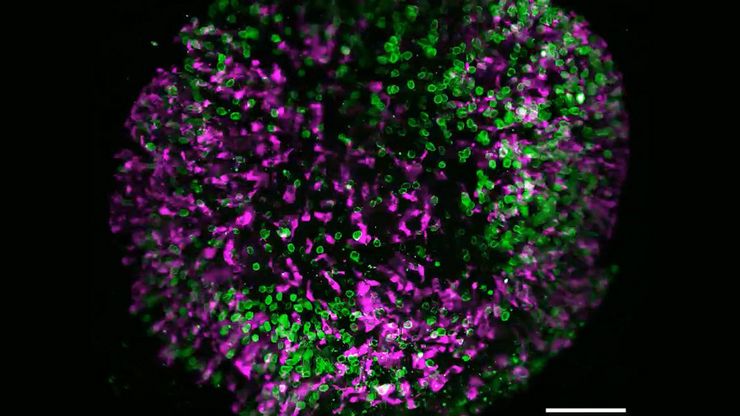
空间蛋白质组学的突破如何拯救生命
中毒性表皮坏死溶解症(TEN)是一种罕见的、但对抗生素或痛风治疗等常见药物的破坏性反应。这种疾病开始时并无大碍,通常只是皮疹,但会迅速升级为大面积皮肤脱落,类似于严重烧伤。尽管 TEN病情十分严重,但其基本机制仍然难以捉摸,治疗方案也仅限于支持性护理。TEN 的死亡率高达 30%,长期以来一直是临床医生的噩梦,直到现在才有了靶向疗法。
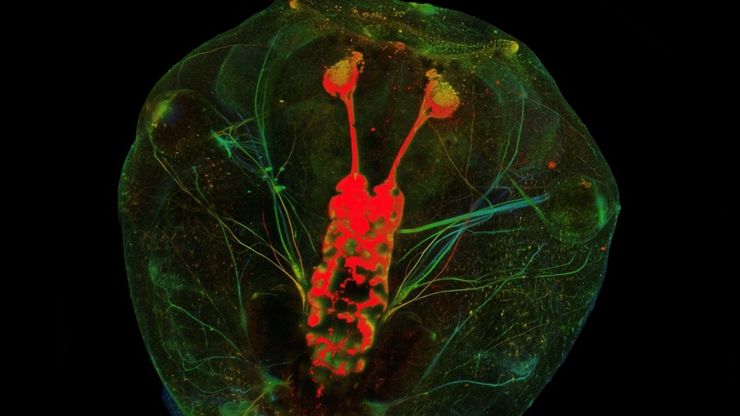
基于激光的视神经再生研究新方法
由于哺乳动物中枢神经系统(CNS)的自我修复能力有限以及传统损伤模型的不一致性,视神经再生是神经生物学的一大挑战。相比之下,爪蟾蝌蚪的视神经在受伤后可以再生,因此是研究轴突再生的分子和细胞机制的理想模型。在本应用说明中,我们展示了如何利用激光显微切割技术(LMD)对蝌蚪的视神经进行精确、一致的横切,从而开发出适合成像、转录组分析和功能恢复研究的高重复性损伤模型。
来捕捉发育动态的3D成像
本应用说明展示了研究人员如何成功利用 Viventis Deep 双视角光片显微镜探索3D多细胞模型(包括有机体、球形体和胚胎)的高分辨率长期成像,从而为发育生物学和疾病研究带来新的可能性。
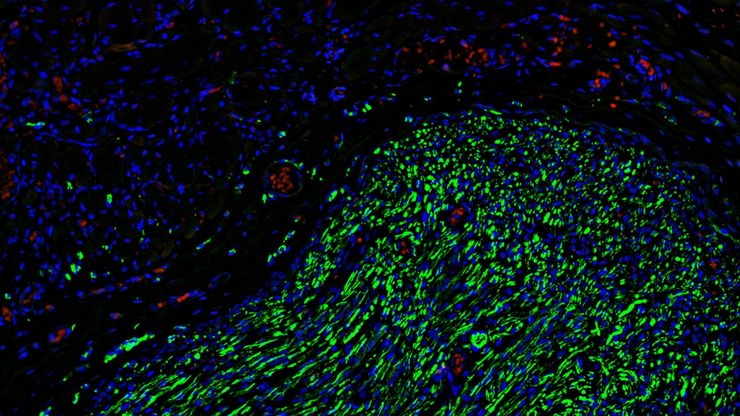
如何为深层肌肉组织中的轴突再生成像
这项研究重点介绍了亚伦-李(Aaron Lee)博士对截肢后肌肉移植中神经再生的定位研究。肢体缺失通常会导致生活质量下降,这不仅是因为组织缺失,还因为轴突再生紊乱引起的神经性疼痛。Mica组织学成像和荧光成像可帮助了解神经再生过程中轴突的生长和分支这项研究有助于塑造未来的神经假体接口设计,改善患者的治疗效果。