引言
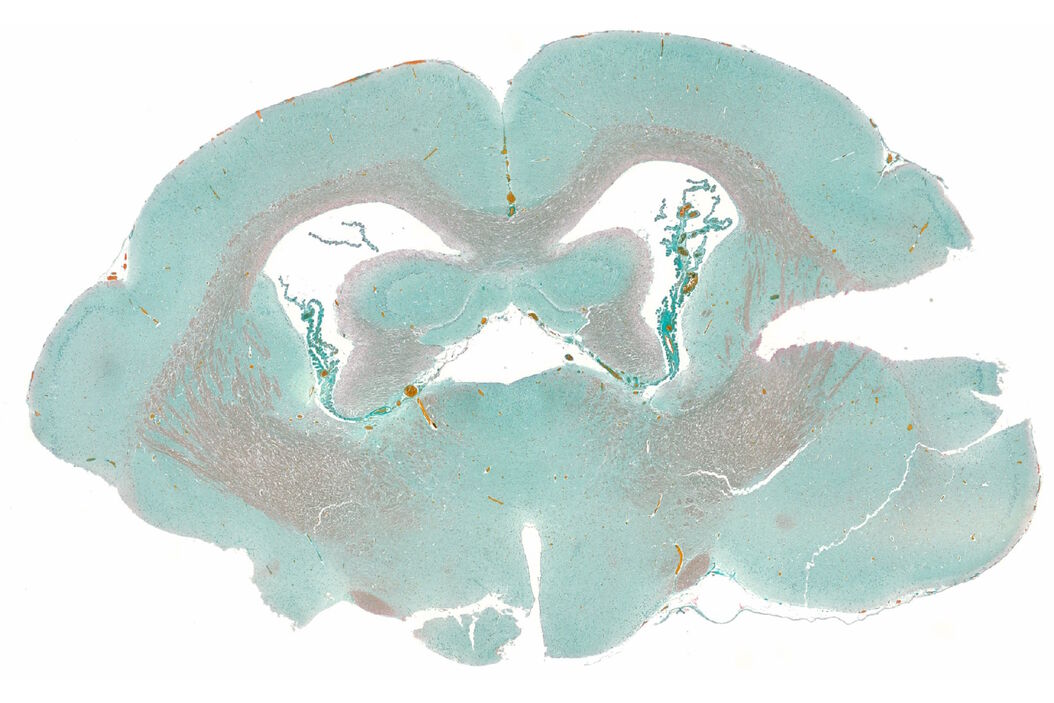
生命体精妙而复杂,生命的复杂性可以通过解析其解剖结构、器官与生理机能的各种细胞和组织来揭示。组织学——这门在亚细胞微观层面研究组织的科学,是生物学研究的基石。它使科学家得以探究细胞内部运作机制、器官构造方式以及生命基本单元的功能基础。
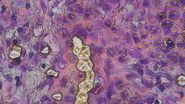
运用组织染色方法的价值在于其能展现组织的亚细胞细节。当实验室制备的新鲜组织切片未经染色时,使用常规显微镜在基础照明下记录的图像缺乏揭示关键细节所需的必要对比度。染色通过增强组织对比度来突显重要特征,从而帮助研究者更好得出结论,例如识别病理学异常。
如何进行染色?
组织学染色包含多种技术,每种技术都有其特定的化合物要求和操作流程。它们大致可分为两类:基于化学的染色和抗体介导的染色。
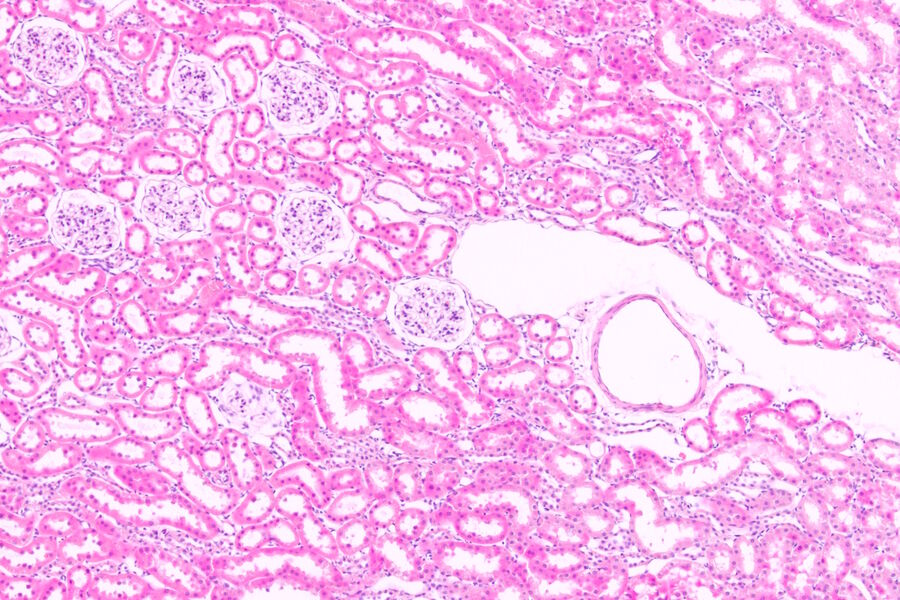
顾名思义,基于化学的染色至少包含一个将组织切片浸入含有染料或染色剂的溶液的步骤。这些化学物质会与特定的亚细胞结构或物质结合,从而赋予组织颜色和对比度。其中最常见的技术之一是苏木精和伊红(H&E)染色,这是全球组织学实验室中的标准染色方法。
与基于化学的染色不同,抗体介导的染色在特异性靶向结构方面提供了更高的灵活性。抗体能选择性结合特定的细胞成分或目标生物标志物。这些抗体或次级抗体通常与酶(如过氧化物酶)标记,酶催化反应生成可见的底物,从而在组织内产生特异且清晰的信号。
传统 RGB 相机如何对组织学样本进行成像
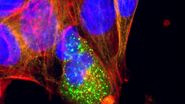
与荧光不同,组织学染色可通过肉眼直接观察。在显微镜下,它利用透射光穿过组织成像,其对比度源自样本对透射光的差异性阻挡。而荧光对比则是通过物镜将特定波长(即颜色)的光照射到样本上,并检测其发射的不同颜色光。因此我们看到的荧光图像是明亮物体置于暗背景上,而组织学图像的对比度恰好相反——暗色物体呈现在明亮背景中。
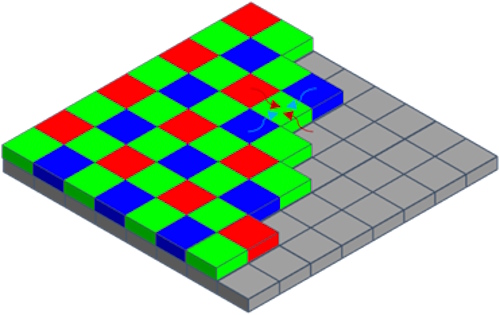
像素的颜色信息由红(R)、绿(G)、蓝(B)三通道强度的平衡表示。然而,仔细观察拜耳矩阵传感器会发现,每个像素仅能探测三种颜色中的一种,这是由像素前方的滤光片决定的。因此,离散的 R、G、B 信息必须合并为复合的 RGB 色彩信息。理论上可通过将 2x2 像素合并为一个值实现,但这会使最终图像仅保留传感器原始像素数的 25%,导致分辨率降低至四分之一。实际采用的方法是从相邻像素中为每个像素插值出 RGB 值(图 2),从而使最终图像与传感器尺寸匹配。这是一项成熟技术,广泛应用于智能手机等多种成像设备中。
FluoSync——完整细节保留技术
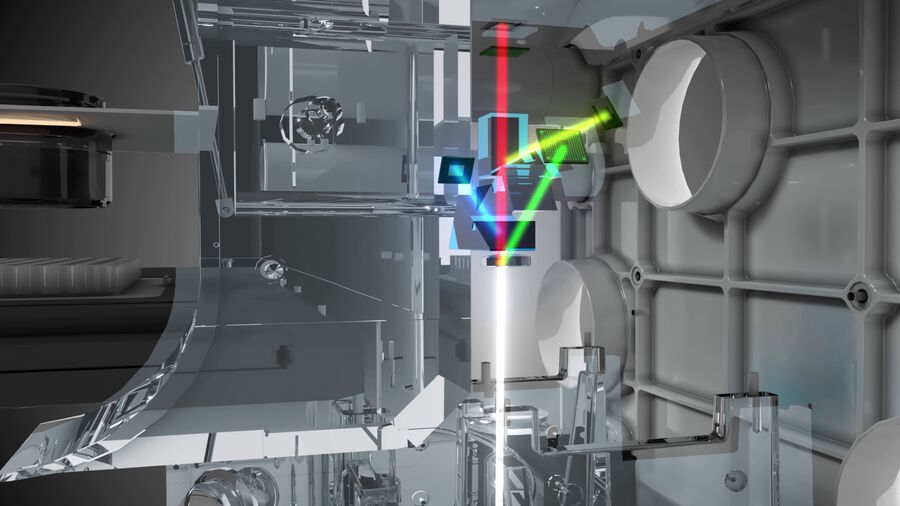
多模态成像系统(Microhub)Mica的 FluoSync 检测方法提出了一种创新方案。该系统采用多传感器阵列,每个传感器专用于捕捉单一颜色。当这些传感器数据合成最终图像时,每种颜色均以全分辨率采集,无需通过插值填补空缺。这使得荧光与 RGB 模式下的多色图像均可实现单次拍摄且保持原始分辨率。研究人员借此可同时获取高分辨率 RGB 与荧光图像,无任何折损。
显微成像面临的挑战
除了纯粹的检测问题外,组织学应用中还存在更多普遍性挑战,Mica同样致力于解决这些问题。
组织学成像常涉及多张玻片及特定兴趣区域的定位需求。本文将探讨Mica如何应对组织学成像的复杂问题,确保研究人员能高效且可靠地开展工作。
组织样本的首要挑战之一在于定位单个或多个样本的相关部位。研究人员需在三维空间中找到样本——即将其置于物镜上方并调焦,需人工筛查整个样本。Mica的Sample Finder样本查找功能通过可用于导航的玻片清晰概览图,显著优化了样本查找这一关键步骤。
Mica的导航器就像一张由卫星图像组成的复杂全球地图。这一直观的功能让研究人员能够放大和缩小组织图像。它将所有捕获或选定的图像叠加在一起,为组织样本提供详细的概览,并保留所有采集的局部背景。显微镜可以高效地引导至单个位置和大面积区域进行成像。
对大组织切片进行成像需要始终保持清晰对焦,这在实际操作中颇具挑战性。Mica将硬件和软件工具结合成易于应用的对焦策略,帮助用户获得一致的对焦效果,即使是在复杂的成像场景中也是如此。
为了能够对多张载玻片进行全面分析,Mica提供了一个四载玻片支架。研究人员可以高效地管理和捕获多张载玻片上的图像,无需手动更换支架上的载玻片,从而提高工作效率。