激光显微切割(LMD)原理
进行显微切割时,需将正置或倒置显微镜与激光器耦合。通过沿目标轮廓移动聚焦激光束,可精确切除样本选定区域甚至单个细胞。该技术确保样本处理过程温和——尤其不会向样本传递任何热量——并提供分析所需的精确材料。
随后,切割物通过多种方式被转移至收集装置。根据所用系统的不同,被切割组织或依靠重力落入反应容器(徕卡LMD系统,参见图1),或逆重力弹射进入反应容器,亦或随附着的膜被间接移除。
激光显微切割技术有哪些用途?
激光显微切割是一种成熟的技术,广泛应用于分子生物学领域,特别是核酸研究、神经科学、发育生物学、癌症研究、法医学、蛋白质组学、植物研究、细胞培养切割及单细胞分离等众多场景[1]。该技术甚至延伸至气候研究领域,尤其在树木年轮分析中发挥作用。
非接触式激光显微切割的方法与技术
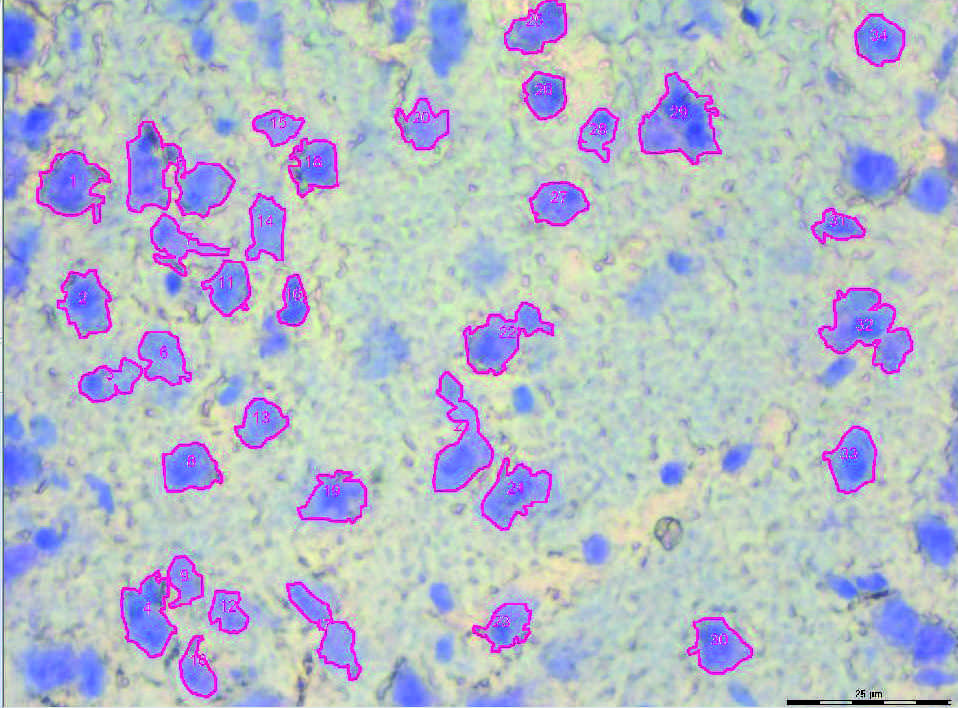
激光显微切割技术为单细胞或组织的分离与筛选提供了精准且无污染的解决方案。组织样本可按照常规制备方法进行包埋、切片和染色。石蜡切片、冰冻切片、涂片样本、染色体标本及细胞培养物均适用于激光显微切割。在电脑屏幕上划定待切割区域后,激光束会自动将其与周围组织分离。荧光标记样本还可通过特殊滤光立方体(可透射全谱激光)实现切割。切割物随即被输送至收集装置(具体方式因系统制造商而异)以供进一步检测。
在徕卡LMD系统中,重力收集法是首选方案——样品固定后,激光束在其上方移动。该方法便于观察样本,并使切割物落入收集器内。
该方法允许使用标准实验室材料进行样本收集,包括单个PCR管至多孔板。直接收集至多孔板对实现高通量至关重要,省去了从单个PCR管移液至多孔板的步骤。对于深度视觉蛋白质组学(DVP)的研究十分受益,既省时省力,又将蛋白质丰度与其在单细胞水平的空间定位相关联 [2]。
激光切割精度与所选放大倍数光学耦合。更高放大倍数下激光束及其移动范围会随视野同步缩小,会自动产生更精细的步进宽度,因为。此过程无需其他操作步骤,不仅可一次性切割单细胞,还能整块切除更大区域。转移切割物至收集装置时,完全避免接触污染风险。
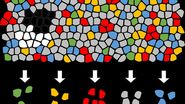
如图 2 所示,激光显微切割结合分子生物学分析的完整流程包含 5 个步骤:
- 样本制备:选择并处理生物样本(组织学样本、活细胞与细胞培养物、染色体铺片、涂片、细胞离心制片、植物材料、精子及其他法医样本)
- 染色:目标区域(ROI)可视化
- 明场染色:HE(苏木精-伊红)、甲酚紫、甲苯胺蓝、硫堇、免疫组织化学
- 荧光染色:二抗、吖啶橙、荧光原位杂交(FISH)
- 激光显微切割:选择性分离目标区域
- 非接触式、无污染,尺寸范围从几微米²的细胞结构至数毫米²,任意形状
- 提取:分离并制备关键分子
- DNA、RNA、蛋白质、代谢物、生物标志物
- 分析:获取可重复且特异性的结果
- 聚合酶链式反应(PCR)、实时定量 PCR、微阵列、表达谱分析、遗传指纹图谱、杂合性缺失(LOH)、荧光原位杂交(FISH)、液相色谱-串联质谱(LC-MS/MS)、二维凝胶电泳(2-D PAGE)、表面增强激光解吸电离(SELDI)、基质辅助激光解吸电离(MALDI)