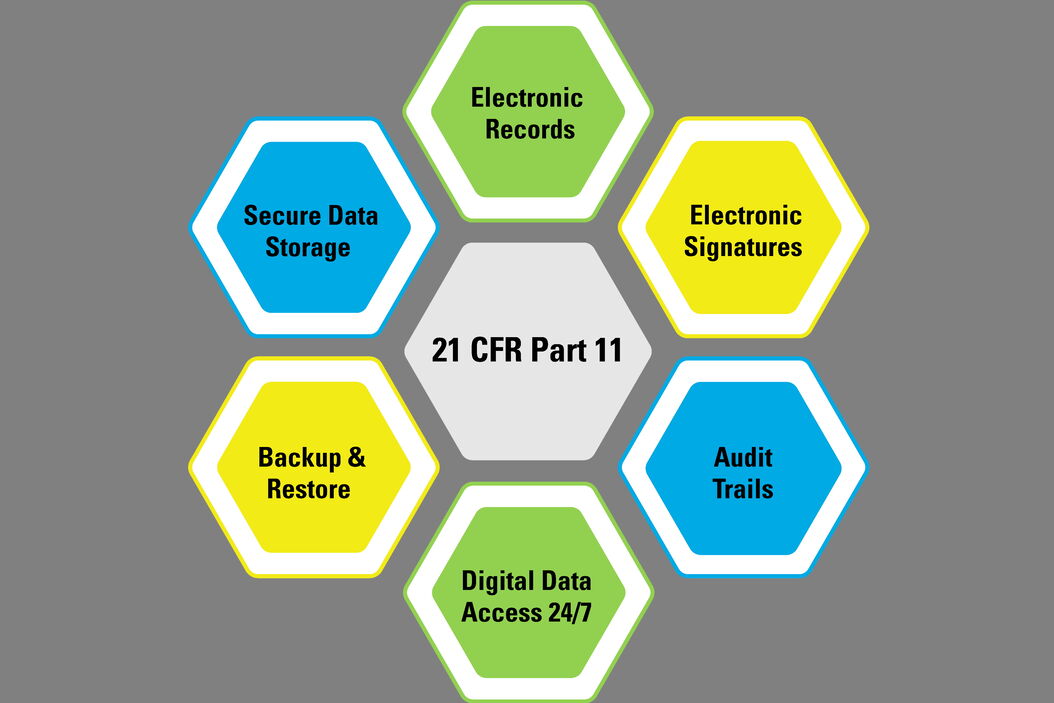
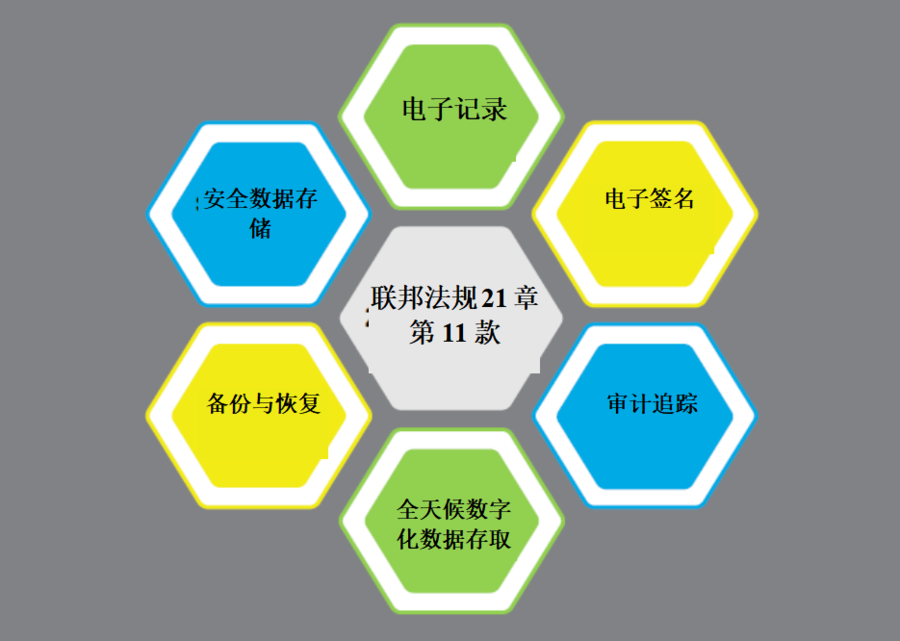
现有的数字化检验方法和满足电子记录相关法规的要求
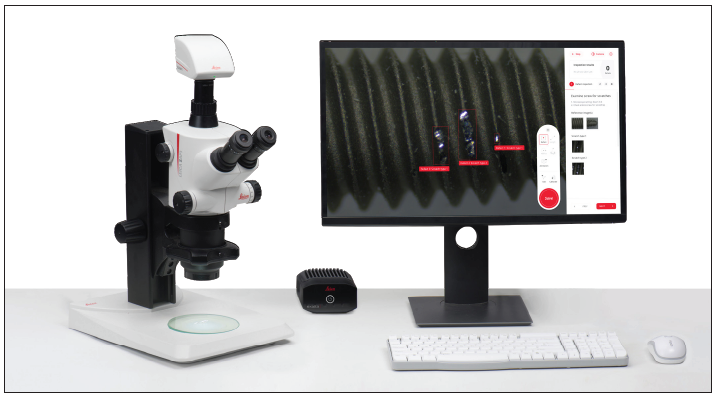
目前用于医疗器械的目测检查方法还没有提高整体检查过程实用性的系统和软件,即有许多手动步骤来检查器械以及输入和传输数据[4,5] 。因此,这会降低满足有关电子记录、批准和签名的法规和指南要求的效率。Leica Microsystems生产的用于可追溯性显微镜的Exalta智能设备(参见图1),现已上市,可帮助用户:i)为医疗器械的实际显微镜检查建立数字化增强解决方案,尽可能地减少手动步骤[4,5] ;ii)由于易于记录可追溯性、电子签名和批准、快速的用户身份验证和实用的审计追踪功能,为符合法规要求做好准备,例如联邦法规第21章第11款和GMP附录11等法规。
总结
本报告概述了美国(FDA联邦法规第21章第11款)、欧盟(GMP附录11)和中国(NMPA规范)关于医疗器械检查中使用电子记录的法规。数字化增强检查比纸质记录方法有显著的优势。这些优势可以产生更一致和更有效的检查结果。但是,电子记录的规定与纸质记录的要求不同,并且可能因国家而异。目前,制造商使用的目测检查方法可能有许多手动步骤,从而降低了遵循这些电子记录规定的效率。Leica Microsystems生产的用于可追溯性显微镜的Exalta智能设备使用户能够建立数字增强化的检查解决方案,以实现更有效的医疗器械质量控制,并帮助他们为符合此类电子记录法规的要求做好准备。