简介
病毒进入宿主细胞需要病毒蛋白与细胞蛋白按照精确顺序协同作用,以触发膜融合。在此,我们展示两项HIV研究中的实例,说明先进的共聚焦显微技术如何实现对活细胞中HIV融合事件进行时间分辨的化学计量分析 [1] ,以及荧光寿命成像(FLIM)如何有助于理解病毒感染对宿主细胞的影响。这一结果通过分子报告系统实现,该系统可对细胞内的生理变化提供荧光读出。当今新一代具备荧光寿命成像能力的共聚焦显微镜,使得在同一实验中使用多种荧光生物传感器成为可能。 将FLIM应用于弗斯特共振能量转移(FRET)检测,还有助于获取更定量的数据。这一方法在阐明细胞代谢在病毒感染性中的作用,以及感染后对细胞代谢的后续影响方面提供了重要信息 [2]。
活细胞中艾滋病毒融合反应的时间分辨化学计量学
掌握病毒进入机制
HIV进入免疫细胞(如巨噬细胞和T细胞)需要病毒颗粒与细胞表面受体相互作用,从而引发一系列复杂且协调的细胞反应。由于未成熟HIV颗粒的糖蛋白刺突结构较为刚性,因此无法有效进入宿主细胞。 [3] 。在病毒颗粒具备感染能力之前,其Gag蛋白需经历切割过程。这一步骤促使结构发生重排,使病毒膜上的受体结合蛋白Env具备流动性。一旦Env蛋白可在膜内自由移动,便能在病毒膜上形成Env三聚体,从而形成宿主膜融合所需的活性膜簇(具体机制详见综述Jakobsdottir等,2017) [4] 。病毒糖蛋白与宿主受体之间的这种相互作用是决定感染是否有效发生的起始关键步骤。因此,对这一感染过程分子机制的更全面理解具有重要意义,有望为开发预防病毒感染的新干预策略提供依据。
通过定量光子计数与荧光寿命信息获取深入认知
荧光寿命成像显微镜(FLIM/FALCON [5] )基于光子计数的先进分析技术均为测量分子动力学与机制的有力工具。STELLARIS平台引入的光子计数技术新进展,提升了对光子事件的进一步分辨能力,并提高了所测荧光信号的准确性 [6] 。利用基于荧光寿命的信息在相同实验中区分多种生物传感器,是阐明病毒入侵过程中复杂多阶段机制的有效手段。STELLARIS平台所集成的共聚焦显微镜技术新进展,使得在共聚焦显微镜上捕获荧光寿命信息成为可能。 [5][7] 。FLIM还可用于测量FRET,这是理解分子间动态空间关系的重要技术。FLIM-FRET被视为金标准技术,因为它相比其他FRET方法(如敏化发射或光漂白)能够提供更稳定且定量的数据。
实时跟踪单个粒子和分子
在研究病毒入侵过程中,一个关键目标是理解病毒颗粒如何与宿主细胞发生物理相互作用。显微技术现已发展到可在分子水平上分析这些相互作用的程度。在荧光显微实验中的任何给定照明体积内,特定分子所产生的最大荧光强度与其总数成正比 [8] 。此外,强度波动的相应振幅会因分子处于单体还是二聚状态而不同 [9] 。这些波动需要借助时间分辨显微技术才能准确量化。利用这一信息,可以追踪单个病毒颗粒以及细胞表面的单个分子,从而获得病毒受体与共受体结合化学计量关系的准确认识。
有三种显微镜方法是实时研究病毒的关键:
- 单病毒颗粒追踪(SVPT)——对单个病毒颗粒进行追踪,并监测其与宿主细胞受体的时空相互作用。病毒颗粒追踪作为细胞分析的锚定点,同时还能将那些与颗粒追踪无关的细胞信号用作内部对照指标。
- 数量& 亮度(N&B) [6] -[8]——通过荧光相关光谱(FCS)可实时监测荧光信号的时间依赖性波动,从而确定特定蛋白质的寡聚状态。该信息可用于评估参与病毒-宿主相互作用的每种受体的数量。
- 交叉相关 N&B(ccN&B) [10],[12] ——两种荧光标记蛋白信号之间的正相关是蛋白质-蛋白质相互作用或蛋白复合物形成的标志。通过对N&B(Number and Brightness)读数进行互相关分析,可以追踪感染过程中宿主受体之间是否发生相互作用,并获得其化学计量关系。此类相互作用是病毒诱导的信号级联反应的起始点。
利用基于荧光强度的定量信号构建 HIV 进入的详细图谱
Iliopolou 等人发表在《自然-结构与分子生物学》(Nature Structural and Molecular Biology)上的一项研究利用这些方法揭示了 HIV 与宿主细胞膜融合的动态过程 [1] 。HIV-1 Env蛋白主要与一个CD4分子和一个CXCR4分子结合,受体与共受体在整个融合过程中相互作用,并与HIV Env三聚体形成复合物。在初始复合物形成后不久,可观察到CXCR4的二聚化。值得注意的是,HIV共受体属于G蛋白偶联受体(GPCR),这种二聚化步骤可能作为触发点,启动宿主侧促进膜重组和融合所需的细胞信号。“CXCR4二聚化”充当HIV颗粒的锚定点,促使更多CD4分子募集,在细胞表面形成更大的复合物。该蛋白复合物的进一步重排有助于反应稳定,并促使共受体发生位移,从而形成融合所需的六螺旋束结构,最终实现病毒颗粒与宿主细胞的融合与入侵。 [1] 。Iliopoulou等人的研究揭示了X4型和R5型病毒在感染过程中具体的时空作用机制。他们的数据表明,前融合复合物的形成涉及三步反应过程。结合这一时间分辨的动态视图及迄今已发表的不同HIV糖蛋白晶体结构,该研究团队得以构建出HIV入侵过程中关键力学变化的详细图景 [1]。
光学生物传感器和寿命成像技术有助于深入探索病毒侵入的分子机制
揭示细胞代谢与病毒易感性之间的这一关联仅仅是冰山一角。直到先进成像技术的出现,才使得深入解析其背后机制成为可能。然而,一个核心问题仍未解决:是病毒改变了细胞代谢,还是细胞代谢的异质性驱动了感染热点的形成 [2] 。为解答这一问题,研究人员利用多种荧光探针和光学生物传感器,检测并关联病毒入侵过程中关键的参数,例如代谢活性、病毒融合事件以及局部膜张力。所有这些生物传感器均采用时间分辨技术进行监测,这对于深入了解诸如病毒入侵等动态生物过程至关重要。荧光寿命成像(FLIM)不仅可在同一实验中使用多个生物传感器,还能在FLIM-FRET应用中生成更可靠且可定量的数据 [8]。
病毒融合生物传感器(iBLAM)
通过使用在融合发生时提供光学读出的报告系统,可以进一步揭示病毒颗粒与宿主细胞之间的相互作用细节。一个典型例子是iBlaM报告系统,该系统将β-内酰胺酶-Vpr融合蛋白包裹在HIV衣壳中。当融合事件发生时,β-内酰胺酶-Vpr进入细胞并切割染料CCF2,使其发射不同波长的光。这一读出信号也可从荧光寿命测量中获益 [16]。
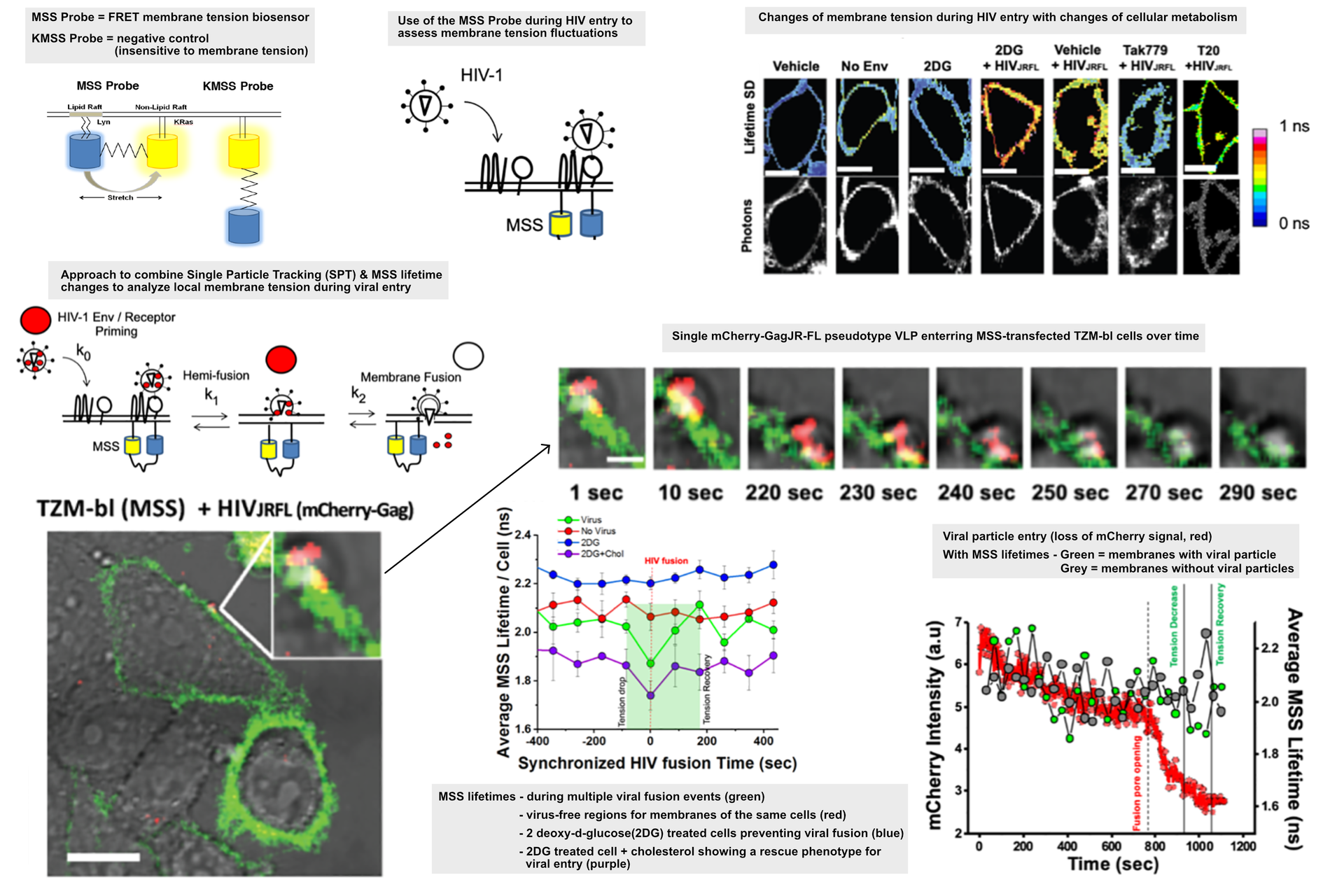
膜张力生物传感器
目前已开发出多种创新生物传感器系统,可提供关于宿主细胞状态的时间分辨信息。当这些传感器被引入感染模型时,能够快速生成关于感染过程的新见解。一种基于FRET的生物传感器被用于提供细胞膜局部张力的光学定量读出信号 [17] 。该生物传感器基于分别与 Lyn 和 KRas 序列相连的 eCFP-Ypet 对 [17] 。荧光寿命信号的变化可反映荧光蛋白在有序与无序膜结构之间被拉伸的程度,进而与膜张力相关联。数据显示,当HIV颗粒发生结合时,局部膜张力出现下降。这一张力降低可通过用2-脱氧葡萄糖处理细胞而得以阻止,该处理通过抑制糖酵解并减少膜上可用胆固醇含量,同时阻止了病毒入侵。在此情况下,膜有序性降低且张力升高,最终抑制了病毒的入侵 [2]。
结论
此处引用的研究突出展示了在HIV研究中取得的一些重要进展,且相同的技术可应用于HIV生命周期不同阶段乃至其他病毒动态过程的研究。本文讨论了用于代谢和膜张力研究的荧光探针与生物传感器,这两者均与病毒入侵研究密切相关。然而,还有大量可用于多种细胞过程的生物传感器尚未涉及。近期已发布的一个数据库可为实验设计提供良好的起点[18] 。选择合适的生物传感器取决于实验拟验证的假设。同时,需考虑生物传感器与所用共聚焦平台的兼容性。在同一次实验中组合使用多种生物传感器,以及利用来自FRET和其他基于荧光系统的寿命信息,有助于从复杂的多步骤宿主-病毒相互作用中获得新的见解。
配备高灵敏度光子计数探测器的现代共聚焦平台能够实现对单分子事件的可视化与定量,并可在实时条件下研究分子水平上的快速变化 [1],[6],[10 ]。荧光寿命成像技术的进步使研究人员能够更充分地利用光学生物传感器,从而更深入地理解驱动HIV细胞入侵与感染的分子过程[2], [5]。最终,该技术将帮助研究人员开发针对HIV感染关键环节的新型干预策略,这些环节对于疫苗研发至关重要。此外,此类方法还可推广应用于其他已知和新发病毒病原体的研究。